摘要:右图曲线a表示放热反应X Z进行过程中X的转化率随时间变化的关系.若要改变起始条件.使反应的过程按b曲线进行.可采取的措施是 A.升高温度 B.加大X的投入量 C.加催化剂 D.增大体积
网址:http://m.1010jiajiao.com/timu3_id_377544[举报]
 (2009?广东)磷单质及其化合物的有广泛应用.
(2009?广东)磷单质及其化合物的有广泛应用.(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
①上述反应中,副产物矿渣可用来
生产水泥等建筑材料
生产水泥等建筑材料
.②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)=CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,△H=
△H1+3△H2+18△H3
△H1+3△H2+18△H3
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个分子产物,其结构式为
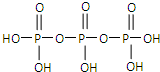
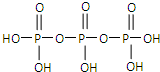
Na5P3O10
Na5P3O10
(3)次磷酸钠(NaH2PO2)可用于化学镀镍.
①NaH2PO2中P元素的化合价为
+1
+1
.②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)
1
1
Ni2++1
1
H2PO2-+H2O
H2O
→1
1
Ni+1
1
H2PO3 -+2H+
2H+
(b)6H2PO2-+2H+=2P+4H2PO3-+3H2↑
请在答题卡上写出并配平反应式(a).
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:
化学镀无需通电,而电镀需要通电
化学镀无需通电,而电镀需要通电
;原理上的相同点:都利用氧化还原反应
都利用氧化还原反应
;化学镀的优点:化学镀对镀件的导电性无特殊要求
化学镀对镀件的导电性无特殊要求
. (2013?崇明县一模)某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案.(忽略锌镀层的氧化)
(2013?崇明县一模)某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案.(忽略锌镀层的氧化)甲同学的方案:先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度.
(1)甲同学的方案是否可行,说出理由:
不可行,Fe也会和盐酸反应
不可行,Fe也会和盐酸反应
.乙同学的方案:通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应,于是设计了如下方案:

(2)配制5%的盐酸1L (ρ=1.025g/cm3 ),需取用36.5% (ρ=1.181g/cm3 )的盐酸
118.9
118.9
mL(保留一位小数).(3)若使用的镀锌铁皮的质量为28.357g,最后称得灼烧后固体的质量为40.000g,镀锌铁皮的长5.00cm,宽5.00cm,锌的密度为7.14g/cm3,则锌层的厚度为
0.001
0.001
cm.丙同学的方案:通过右图所示装置,测量镀锌铁皮与稀H2SO4反应产生气体的质量来计算锌层的厚度.己称得镀锌铁皮质量为18.200g.
(4)实验所用称量仪器为
电子天平
电子天平
.(5)若改用浓盐酸,则测出锌的厚度会
偏小
偏小
(填“偏大”、“偏小”、或“无影响”).(6)实验后,将乙同学和丙同学的结果进行比较,发现他们对同种镀锌铁皮的测量结果差异很大,你认为谁的方案更加可靠呢?
乙
乙
理由是:丙的方案中气体会带走水蒸气,易造成干扰
丙的方案中气体会带走水蒸气,易造成干扰
. 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),
设计实验方案来研究影响反应速率的因素.
(1)甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. |
反应快慢:Mg>Fe>Cu | 反应物的性质越活泼,反应速度越快 |
反应物本身的性质
反应物本身的性质
对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持温度
温度
相同.(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验.完成该实验应选用的实验药品是
0.5mol/L、2mol/L
0.5mol/L、2mol/L
;应该测定的实验数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间
测定一定时间产生气体的体积或测定产生一定体积的气体所需时间
. (2011?咸阳模拟)[化学-选修物质结构与性质]
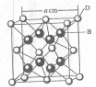
(2011?咸阳模拟)[化学-选修物质结构与性质]已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期也不在同一主族.B原子的L层有1对成对电子且其单质是空气的主要成分.C原子的L层p轨道中有5个电子;D是周期表中1--18列中的第14列元素;D元素原子次外层电子数与最外层电子数之比为4:1. E跟C可形成离子化合物,其晶胞结构如右图.请回答:
(1)A与D形成的最简单化合物的分子式是
SiH4
SiH4
,该分子的立体构型是正四面体
正四面体
.该分子属于非极
非极
(填“极性”或“非极性”)分子(2)C与D形成的化合物晶体类型是
分子晶体
分子晶体
.B单质分子中含1
1
个σ键2
2
个π键(3)C的电子排布图
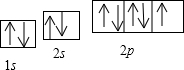

(4)从上图中可以看出,E踉C形成的化合物的化学式为
CaF2
CaF2
;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是
| ||
| a3cm3 |
| ||
| a3cm3 |
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
①估计钙元素的电负性的取值范围:
0.8
0.8
<X<1.2
1.2
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于17时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlC13中形成的化学键的类型及其理由是
共价键,因为AlCl3中氯与铝的电负性差值为1.5小于1.7,故AlCl3中化学键为共价键
共价键,因为AlCl3中氯与铝的电负性差值为1.5小于1.7,故AlCl3中化学键为共价键
.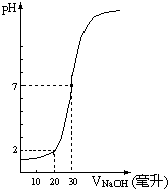 下图为10mL一定物质的量浓度的盐酸X,用一定物质的量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量的浓度是( )
下图为10mL一定物质的量浓度的盐酸X,用一定物质的量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量的浓度是( )