摘要:19.叠氮酸钠(NaN3)是抗禽流感药物“达菲 合成过程中的中间活性物质. (1)NaN3中存在的化学键有 . a.离子键 b.极性键 c.非极性键 d.金属键 (2)配平下列反应的离子方程式 N3-+ MnO4-+ H+ → Mn2+ + NO + Mn2+是 产物.产生6.72 LNO转移的电子为 mol. (3)3mol NaN3受撞击会生成4mol 氮气和一种离子化合物A.可用于汽车保护气囊.请写出有关反应的化学方程式 .
网址:http://m.1010jiajiao.com/timu3_id_377311[举报]
叠氮酸钠(NaN3)是无色离子晶体,遇高温或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一.下列有关说法正确的是( )
| A、NaN3中只含有离子键 | B、1molNaN3完全分解最多可以产生33.6LN2 | C、NaN3快速分解时,NaN3既是氧化剂,又是还原剂 | D、常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项 |
 (2013?江苏三模)在5-氨基四唑(
(2013?江苏三模)在5-氨基四唑(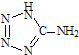 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.(1)基态Ga原子的电子排布式可表示为
[Ar]3d104s24p1
[Ar]3d104s24p1
;(2)5-氨基四唑中所含元素的电负性由大到小的顺序为
N>C>H
N>C>H
,其中N原子的杂化类型为sp2、sp3
sp2、sp3
;在1mol 5-氨基四唑中含有的σ键的数目为9NA
9NA
.(3)叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为
直线型
直线型
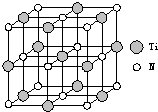
.②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物.其结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,这种碳氮化钛化合物的化学式为
Ti4CN3
Ti4CN3
.