摘要:12.X.Y.Z为短周期元素.X原子最外层只有一个电子.Y原子的最外层电子数比内层电子数少4.Z的最外层电子数是内层电子总数的3倍.下列有关叙述正确的是 ( ) A.X肯定为碱金属元素 B.稳定性:Y的氢化物>Z的氢化物 20070316 C.X.Y两元素形成的化合物一定为离子化合物 D.Y.Z两元素形成的化合物熔点较低 20070404 13.利用下列各组中的物质制备并收集少量相应的气体.能采用右图装置的是 ( ) ①浓氨水和固体NaOH制NH3 ②大理石和稀盐酸制CO2 ③过氧化氢溶液和二氧化锰制O2 ④稀硝酸和铜片制NO ⑤浓盐酸和二氧化锰制Cl2 ⑥电石和水制C2H2 ⑦锌粒和稀硫酸制H2 ⑧乙醇和浓硫酸制C2H4 A.②③ B.①⑥⑦ C.②⑤⑧ D.①④⑥ 选择题答题栏
网址:http://m.1010jiajiao.com/timu3_id_377192[举报]
有X、Y、Z、W四种短周期主族元素,原子序数依次增大.X元素与其它元素不在同一周期.Y、Z在同周期表中处于相邻位置,它们的单质在通常状况下均为无色气体.W原子的最外层电子数是核外电子层数的2倍.请回答:
(1)W在元素周期表位置
(2)写出X与Z形成的10电子阳离子的化学式
(3)由上述四种元素中的某两种元素所形成的具有漂白作用的物质的化学式是:
(4)W的最高价氧化物的水化物有强氧化性,加热时金属铜可被它氧化,该反应的化学方程式为
(5)由X、Y、Z、W四种元素组成的多种无机酸酸式盐,写出其中一种与足量的NaOH溶液在加热条件下反应的离子方程式为:
查看习题详情和答案>>
(1)W在元素周期表位置
第三周期、VIA族
第三周期、VIA族
.(2)写出X与Z形成的10电子阳离子的化学式
H3O+
H3O+
.(3)由上述四种元素中的某两种元素所形成的具有漂白作用的物质的化学式是:
SO2或H2O2
SO2或H2O2
(任意写一种).(4)W的最高价氧化物的水化物有强氧化性,加热时金属铜可被它氧化,该反应的化学方程式为
2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O
| ||
2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O
.
| ||
(5)由X、Y、Z、W四种元素组成的多种无机酸酸式盐,写出其中一种与足量的NaOH溶液在加热条件下反应的离子方程式为:
NH4++HSO3-+2OH-
NH3↑+2H2O+SO32-或NH4++H++2OH-
NH3↑+2H2O
| ||
| ||
NH4++HSO3-+2OH-
NH3↑+2H2O+SO32-或NH4++H++2OH-
NH3↑+2H2O
.
| ||
| ||
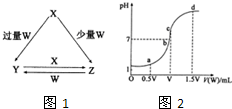 (2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去).
(2013?菏泽二模)X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图1所示(水及部分产物已略去). (1)若X为金属单质,W是某强酸的稀溶液.X与少量W反应生成Z的离子方程式为
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
,向Y溶液中加入某种试剂硫氰化钾
硫氰化钾
(填试剂名称),若溶液出现血红色,即可判断Y溶液中阳离子的存在.(2)若X、Y为正盐,X的水溶液显酸性,W为NaOH溶液,写出Y与X在水溶液中转化为Z的离子反应方程式
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.(3)若X为强碱,常温下W为有刺激性气味的气态氧化物.常温时,将Z的水溶液露置于空气中,溶液的PH变化是
变小
变小
(填“变大”、“变小”、“不变”.不考虑水的挥发),其原因是亚硫酸根离子有还原性,易被空气中的氧气氧化生成硫酸根离子,2SO32-+O2=2SO42-,所以溶液的pH变小
亚硫酸根离子有还原性,易被空气中的氧气氧化生成硫酸根离子,2SO32-+O2=2SO42-,所以溶液的pH变小
(用简要的文字说明,并写出离子方程式)(4)室温下,若用0.1mol/L的NaOH溶液滴定VmL0.1mol/L HA溶液,滴定曲线如2图所示,则a、b、c、d四点溶液中水的电离程度最大的是
c
c
点;a点溶液中离子浓度的大小顺序为c(A-)>c(Na+)>c(H+)>c(OH-)
c(A-)>c(Na+)>c(H+)>c(OH-)
;取少量c点溶液于试管中,再滴加0.1mol/L盐酸至中性,此时溶液中除H+、OH-外,离子浓度的大小顺序为c(Na+)>c(A-)>c(Cl-)
c(Na+)>c(A-)>c(Cl-)
. 右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )