网址:http://m.1010jiajiao.com/timu3_id_377151[举报]
我国有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。镁因其合金性能卓越,在汽车、飞机制造方面很重要,有“国防金属”之称。发达国家多数从海洋中提镁,中国海水提镁技术也在不断进步。海水中虽含镁离子很多,但它是很分散的(1.28 g?L-1),要提取镁首先应让镁离子与其它离子等分离。
请回答下列问题:
(1)某化学兴趣小组利用煅烧海边贝壳所得产物,投入浓缩的海水中,最终变成了Mg(OH)2浊液。请写出最后一步反应的离子方程式: 。
(2)已知,氧化镁熔点2852℃,氯化镁的熔点714℃。无水氯化镁是工业制取镁的原料。试写出实验室蒸发氯化镁溶液制取无水氯化镁必需的实验仪器是 ;某同学对蒸发得到的固体,用酒精喷灯加热却不能熔化,请你试分析原因

(3)火力发电在江苏的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 。
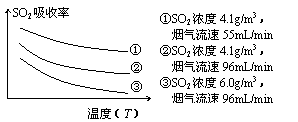 ②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。
查看习题详情和答案>>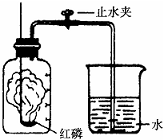 某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:①将图中的集气瓶分为5等份,并作好标记.
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹
夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞.
③充分反应后,待集气瓶冷却至室温,打开止水夹.
请回答下列问题:
(1)该实验中红磷需稍过量,目的是
其反应的文字表达式为
| 点燃 |
| 点燃 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
| 1 |
| 5 |
(2)该实验可推论出氮气
(3)若将红磷换成炭粉,该实验能否获得成功?为什么?
(4)某同学对实验进行反思后,提出了改进方法(如图所示 ),你认为改进后的优点是:
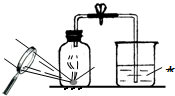
(4)图是测定空气中中氧气含量的实验.在实验过程中,观察到红磷燃烧的现象是:剧烈燃烧、放出大量热和
(一)提出猜想:
(二)查阅资料:①Cu2O属于碱性氧化物; ②Cu+在酸性条件下能发生自身氧化还原反应;③在空气中灼烧Cu2O能生成CuO.
(三)制备红色沉淀:①制备氢氧化铜悬浊液②氢氧化铜悬浊液与葡萄糖共热.③过滤、洗涤、低温烘干得红色粉末.
(四)红色沉淀探究
该同学设计了四种方案:
方案Ⅰ:取该红色粉末溶于足量稀硝酸中,观察溶液颜色变化.
方案Ⅱ:取该红色粉末溶于足量稀硫酸中,观察是否有残渣.
方案Ⅲ:称得干燥坩埚a g,取红色粉末置于坩埚中再称得质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量,反复多次直到质量不变,称得最后质量为c g,比较a、b、c的关系.
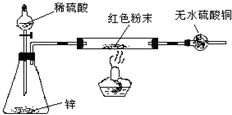
方案Ⅳ:装置如图所示:(夹持仪器略去)
试回答下列问题:
(1)请你评价方案Ⅰ和方案Ⅱ.如果你认为该方案合理,请简述其工作原理;
如果你认为该方案不合理,请简述原因.
(2)方案Ⅲ中,如果a、b、c的关系符合c=
(3)方案Ⅳ中,实验前应检验装置气密性,请简述如何检验.
(4)方案Ⅳ中,要测定红色粉末的成分,必须测定下列哪些物理量
①通入氢气体积 ②反应前,红色粉末+双通管的总质量 ③实验前干燥管的质量④完全反应后,红色粉末+双通管的总质量 ⑤双通管的质量 ⑥锌粒质量 ⑦稀硫酸的物质的量浓度 ⑧实验后干燥管的质量 ⑨实验条件下的大气压强和室温
(5)有人提出,在氢气发生器与双通管之间应加一个干燥装置,你认为

实验结论.实验A、B、C所用试剂或所得结论列于下表中.
| 序 号 |
实验药品 | 实验结论 | ||
| 甲 | 乙 | 丙 | ||
| A | ① | 二氧化锰 | ② | 氧化性:O2>S |
| B | 醋酸溶液 | 碳酸钠溶液 | 硅酸钠溶液 | ③ |
| C | ④ | ⑤ | 氯化铝溶液 | 碱性:NaOH>NH3.H2O>Al(OH)3 |
(2)请填写①~⑤的试剂名称或实验结论:
①
(3)小明利用该装置自行设计了一个实验--证明NO2具有氧化性(注:丙中已事先添加Na2S溶液).据此回答下列问题:
①如何检验该装置的气密性:
②打开甲装置的活塞后,装置乙中发生反应的化学方程式为:
③某同学对小明的实验设计提出了质疑,认为丙中溶液变浑浊不足以证明NO2具有氧化性,你认为他的理由是:
④NO2气体有毒,应用NaOH溶液吸收,请写出此反应的离子方程式:
(1)测得某废腐蚀液中含CuCl2 1.5mol/L,含FeCl2 3.5mol/L,含FeCl3 1.0mol/L,含HCl 3.0mol/L.取废腐蚀液200mL按如下流程在实验室进行实验(如图1):
回答下列问题:
①废腐蚀液中加入过量铁粉后,发生的离子反应为
②检验废腐蚀液中含有Fe3+实验操作是
③有滤渣的到纯铜除杂所需试剂是
(2)如图2是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置.
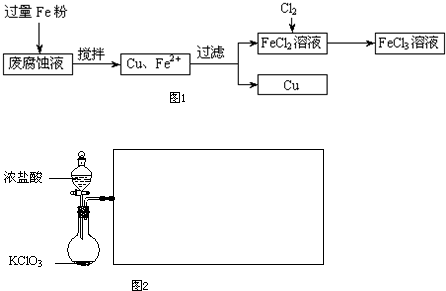
①方框内仪器没有画出,请直接在原图上将其补充完整
②实验开始前,某同学对实验装置进行了气密性检验,方法是