网址:http://m.1010jiajiao.com/timu3_id_376726[举报]
|
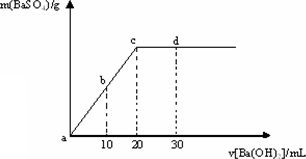
常温下,向0.1mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中正确的是
| |
A. |
溶液的导电能力:a<b<d<c |
B. |
溶液的pH:a<b<c<d |
C. |
a溶液和b溶液呈酸性 |
D. |
c溶液和d溶液呈碱性 |
(14分)在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)b=____________,x =" ______mL" 。
(3)反应③的离子方程式为____________________________
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)= ;
(5) 与NaHSO4相同, NaHSO3和NaHCO3也为酸式盐。已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是___________(填正确答案的标号)。
A.c(
 )>c(
)>c( )>c(
)>c( )>c(
)>c( )>c(
)>c( )
)B.c(
 )+c(
)+c( )=c(
)=c( )+2c(
)+2c( )+c(
)+c( )
)C.c(
 )+c(
)+c( )=c(
)=c( )+c(
)+c( )
)D.两溶液中c(
 )、c(
)、c( )、c(
)、c( )分别相等
查看习题详情和答案>>
)分别相等
查看习题详情和答案>>
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)b=____________,x =" ______mL" 。
(3)反应③的离子方程式为____________________________
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)= ;
(5) 与NaHSO4相同, NaHSO3和NaHCO3也为酸式盐。已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是___________(填正确答案的标号)。
A.c(
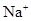 )>c(
)>c(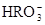 )>c(
)>c(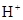 )>c(
)>c(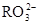 )>c(
)>c(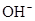 )
)B.c(
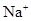 )+c(
)+c(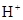 )=c(
)=c(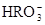 )+2c(
)+2c(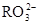 )+c(
)+c(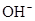 )
)C.c(
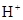 )+c(
)+c(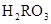 )=c(
)=c(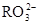 )+c(
)+c(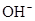 )
)D.两溶液中c(
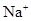 )、c(
)、c(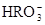 )、c(
)、c(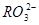 )分别相等
)分别相等(16分)运用相关原理,回答下列各小 题:
题:
Ⅰ.已知NaHSO4在水中的电离方程式为NaHSO4=Na++ H++ SO4 2-。
2-。
(1)在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填“>”、“=”或“< ”
” 下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
(2)将 20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
0.001 mol·L-1BaCl2溶液,首先析出的沉淀是 。[KSP(BaSO4)=1.1×10-10mol2·L-2;KSP(BaCO3)=5.1×10-9mol2·L-2]
Ⅱ.已知:在25时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH
 H++CH3COO--> Ka=1.8×10-5
H++CH3COO--> Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 。当升高温度时,Kh将 (填“增大”“减小”“不变”);
(4)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)
 为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(5)0.9mol·L-1醋酸钠溶液中[OH-]= mol·L-1
在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14、 =2.2)
=2.2)
 题:
题:Ⅰ.已知NaHSO4在水中的电离方程式为NaHSO4=Na++ H++ SO4
 2-。
2-。(1)在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填“>”、“=”或“<
 ”
” 下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。(2)将
 20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加0.001 mol·L-1BaCl2溶液,首先析出的沉淀是 。[KSP(BaSO4)=1.1×10-10mol2·L-2;KSP(BaCO3)=5.1×10-9mol2·L-2]
Ⅱ.已知:在25时 H2O
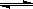 H++OH- KW=10-14
H++OH- KW=10-14 CH3COOH
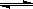
 H++CH3COO--> Ka=1.8×10-5
H++CH3COO--> Ka=1.8×10-5(3)醋酸钠水解的平衡常数Kh的表达式为 。当升高温度时,Kh将 (填“增大”“减小”“不变”);
(4)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)

 为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);(5)0.9mol·L-1醋酸钠溶液中[OH-]= mol·L-1
在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14、
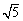 =2.2)
=2.2)