摘要:六价的铬有剧毒[b21] .所以要对含Cr(Ⅵ)(括号内罗马数字表示元素的价态.下同)废水进行化学处理.最常见的是铁氧磁体法.即把FeSO4·7H2O加入含Cr(Ⅵ)的废水中.在pH<4时.Fe2+还原Cr.调节溶液pH达8-10.使溶液中的Fe析出组成相当于FeⅡ[Fe·Cr]O4沉淀.试回答: (1)若废水中.六价铬以Cr2O72-存在.试写出在酸性条件下硫酸亚铁还原Cr2O72-的离子方程式: . 的结果可确定铁氧磁体中x= . 的结果.若废水中Cr(Ⅵ)按CrO3计.则加入的FeSO4·7H2O与CrO3的质量比应为多少才能除去废水的Cr(Ⅵ).m(FeSO4·7H2O)/m(CrO3)= . [b1]A [b2]C [b3]D [b4]B [b5]D [b6]A [b7]AB [b8]D [b9]C [b10]BD [b11]A [b12]B [b13]CD [b14]AD [b15]B [b16]A [b17]得到 ,还原, 失去, 氧化, 2Fe+3Cl22FeCl3,+3,Fe+2HCl====FeCl2+H2↑,+2?,强 [b18]氮和硫,碳,KNO3和硫,碳 ,CO2 ,K2S和NO2 . [b19]还原性,氧化性,还原,氧化,CO2+4Fe2++5H2O=CH2O+3Fe2O3+8H+ [b20](1)是,MnO2,浓盐酸,4H++2Cl-+MnO2Cl2↑+Mn2++2H2O, (2)除去氯气中混有的HCl气体 (4)浓盐酸的物质的量浓度是: 被氧化的HCl的物质的量为:(5.6L/22.4L·mol-1)×2=0.5mol (提示:由化学反应方程式可知.氯气是氧化产物.1mol氯气生成.则有2mol的HCl被氧化). [b21](1)Cr2O72- +14H+ +6Fe2+ =2Cr3+ +6Fe3+ +7H2O 13.9
网址:http://m.1010jiajiao.com/timu3_id_37664[举报]
六价的铬有剧毒,所以要对含Cr(Ⅵ)(罗马数字表示元素的价态,下同)废水进行化学处理,最常见的是铁氧磁体法,即把FeSO4·7H2O加入含Cr(Ⅵ)的废水中,在pH<4时,Fe2+还原Cr(Ⅵ)为Cr(Ⅲ)。调节溶液pH达8—10,使溶液中的Fe(Ⅱ)、Fe(Ⅲ)、Cr(Ⅲ)析出组成相当于 (磁性材料铁氧体的组成)的沉淀。试完成下列问题:
(磁性材料铁氧体的组成)的沉淀。试完成下列问题:
(1)若废水中六价铬以![]() 存在,试写出在酸性条件下硫酸亚铁还原
存在,试写出在酸性条件下硫酸亚铁还原![]() 的离子反应方程式并配平:_______________________。
的离子反应方程式并配平:_______________________。
(2)由(1)的结果可确定铁氧磁体中x=__________。
(3)据(2)的结果,若废水中Cr(Ⅵ)按CrO3计,则加入的FeSO4·7H2O与CrO3的质量比应为多少才能除去废水中的Cr(Ⅵ), ![]()
酒后驾车能使交通事故增加。为了整顿这种现象,国家有关部门开始使用一种仪器,用于检查司机是否酒后驾驶。其原理是酒精可以与重铬酸钾(K2Cr2O7)反应,重铬酸钾能把乙醇氧化成乙酸,六价的铬离子被还原成三价而由橙红变为绿色。主要反应可用下列化学方程式表示:
![]()
其中![]() 、
、![]() 分别是( )。
分别是( )。
A.2、8 B.11、2 C.2、11 D.4、9
查看习题详情和答案>>(2009?静安区二模)H2O2既有氧化性又有还原性,在+2价的锰盐或+3价的铬盐等催化下还会发生自身氧化还原反应生成H2O和O2.
(1)完成并配平以下离子方程式:
若有0.1mol H2O2 参加反应,转移的电子数为
(2)完成并配平以下化学方程式:
①反应中的氧化剂是
②若化学方程式中KMnO4、H2O2的系数分别是2和7,也能配平这个方程式,但此时H2O2除了跟KMnO4反应外,还发生的反应是(用化学方程式表示)
查看习题详情和答案>>
(1)完成并配平以下离子方程式:
1
1
H2O2+2
2
Fe2++2
2
H+
H+
→2
2
Fe3++2
2
H2O
H2O
若有0.1mol H2O2 参加反应,转移的电子数为
0.2NA
0.2NA
个.(2)完成并配平以下化学方程式:
2
2
KMnO4+5
5
H2O2+3
3
H2SO4
H2SO4
→2
2
MnSO4+1
1
K2SO4+5
5
O2↑
O2↑
+8
8
H2O①反应中的氧化剂是
KMnO4
KMnO4
;被氧化的元素是-1价的O
-1价的O
.②若化学方程式中KMnO4、H2O2的系数分别是2和7,也能配平这个方程式,但此时H2O2除了跟KMnO4反应外,还发生的反应是(用化学方程式表示)
2H2O2→2H2O+O2↑
2H2O2→2H2O+O2↑
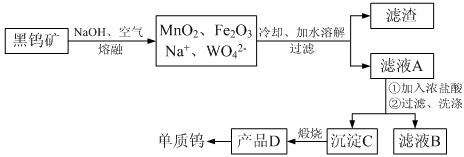
.自然界钨主要以钨(+6)酸盐的形式存在,黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4).黑钨矿传统冶炼工艺流程图如下:

(1)写出上述第一步转化中生成MnO2的化学反应方程式
(2)检验沉淀C是否洗涤干净的操作是
(3)已知上述转化中W的化合价未发生变化,将产品D用碳或氢气还原均可得到钨,根据实际生产需要,请你选择合适的还原剂,说明理由:
(4)产品D有一种蓝色非整比的存在形态,其化学式为WO3-x,该化合物中存在五价和六价两种价态的钨.若x=0.1,则化合物中五价和六价的钨原子数之比为
查看习题详情和答案>>

(1)写出上述第一步转化中生成MnO2的化学反应方程式
2MnWO4+O2+4NaOH=2MnO2+2Na2WO4+2H2O
2MnWO4+O2+4NaOH=2MnO2+2Na2WO4+2H2O
;整个转化过程中黑钨矿被氧化的元素是Mn、Fe
Mn、Fe
.(2)检验沉淀C是否洗涤干净的操作是
取最后一次的洗涤液,滴加AgNO3溶液,若无白色沉淀产生则已洗涤干净,反之则未洗净
取最后一次的洗涤液,滴加AgNO3溶液,若无白色沉淀产生则已洗涤干净,反之则未洗净
.(3)已知上述转化中W的化合价未发生变化,将产品D用碳或氢气还原均可得到钨,根据实际生产需要,请你选择合适的还原剂,说明理由:
若选择碳,降低冶炼成本;若选择H2,则是对所得产品的纯度要求就很高,但冶炼成本高
若选择碳,降低冶炼成本;若选择H2,则是对所得产品的纯度要求就很高,但冶炼成本高
.(4)产品D有一种蓝色非整比的存在形态,其化学式为WO3-x,该化合物中存在五价和六价两种价态的钨.若x=0.1,则化合物中五价和六价的钨原子数之比为
1:4
1:4
.