摘要:22.请按要求填空: ㈠下列实验操作或实验叙述正确的是 . ①配制氯化亚铁溶液时.需加少量盐酸及铁粉, ②用10mL量筒量取5.80mL盐酸, ③用稀醋酸除去热水瓶内的水垢, ④检验卤代烃中卤素时.直接将卤代烃加入硝酸酸化的硝酸银溶液中 ⑤金属钠着火可用干燥的细沙扑灭, ⑥用排水法收集氢气时.不需要检验纯度.可直接点燃, ⑦检验碳酸钠溶液中是否混有氢氧化钠可先加足量的氯化钙溶液.再滴入酚酞试液, ⑧可用过滤法除去氧氢化铁胶体中少量的氯化铁和盐酸. ㈡下列试剂和图中的仪器可用来制备氯气.溴单质.氧气和溴乙烷等. 试剂有:二氧化锰.氯酸钾.氯化钾.溴化钾.双氧水.浓硫酸.乙醇.NaOH.水等. 仪器见下图. 请填空: (1)组装制O2的发生装置选用的仪器是 .化学方程式为 . (2)利用 仪器可作为制溴单质的发生装置.制取反应的化学方程式为 . (3)已知溴乙烷是一种难溶于水的无色液体.密度约为水的1.5倍.沸点为38.4℃,乙醇沸点为78.5℃,HBr的沸点为-67℃.Br2的沸点为58.8℃.密度为3.12g·cm-3. ①收集溴乙烷时.选C和D.而不选D和E的理由是 .橡皮塞孔4接10端而不接11端的理由是 . ②从棕黄色的粗溴乙烷中制取无色的溴乙烷.应加入的试剂是 .必须使用的主要仪器是 .
网址:http://m.1010jiajiao.com/timu3_id_376582[举报]
钠、氯及其化合物有如下转化关系,请按要求填空:
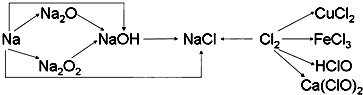
(1)金属钠的密度比水
(2)Na2O2是
(3)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为
(4)漂白粉的有效成份是
查看习题详情和答案>>

(1)金属钠的密度比水
小
小
,实验室中金属钠通常保存在煤油
煤油
中.一小块金属钠投入水中的反应方程式是2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.(2)Na2O2是
淡黄
淡黄
色的固体,Na2O2的重要用途是做呼吸面具
做呼吸面具
,有关反应的化学方程式为2Na2O2+CO2═2Na2CO3+O2
2Na2O2+CO2═2Na2CO3+O2
.(3)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.(4)漂白粉的有效成份是
Ca(ClO)2
Ca(ClO)2
(填化学式),漂白粉溶于水后,受空气中的CO2作用,产生有漂白、杀菌作用的次氯酸,化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
.下图为某些常见物质之间的转化关系.已知:A、B、I中含有相同的阳离子且都是XY2型化合物,且I是实验室常用的干燥剂;C为直线型分子;E、F为非金属气体单质.
请按要求填空:

(1)①B的电子式是
 ,②K的结构式是
,②K的结构式是
(2)D与G反应的化学方程式是
(3)已知C的燃烧热是1300kJ/mol,表示C的燃烧热的热化学方程式是
(4)将G溶于水配成溶液,简述检验该溶液G中所含阳离子的操作方法:
(5)常温下0.1mol/L的J溶液中c(H+)/c(OH-)=1×10-8,下列叙述错误的是
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1mol/L的J溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH值为9;
(6)单质F在工业上有重要的用途是
查看习题详情和答案>>
请按要求填空:

(1)①B的电子式是


H-O-Cl
H-O-Cl
;(2)D与G反应的化学方程式是
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
;
| ||
(3)已知C的燃烧热是1300kJ/mol,表示C的燃烧热的热化学方程式是
C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol
| 5 |
| 2 |
C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol
;| 5 |
| 2 |
(4)将G溶于水配成溶液,简述检验该溶液G中所含阳离子的操作方法:
取少量的G溶液于试管中,加入适量的氢氧化钠溶液,加热试管,将湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则含有NH4+,(其他合理答案均给分)
取少量的G溶液于试管中,加入适量的氢氧化钠溶液,加热试管,将湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则含有NH4+,(其他合理答案均给分)
;(5)常温下0.1mol/L的J溶液中c(H+)/c(OH-)=1×10-8,下列叙述错误的是
BCE
BCE
;A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1mol/L的J溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH值为9;
(6)单质F在工业上有重要的用途是
制漂白粉,制盐酸(制漂白液等)
制漂白粉,制盐酸(制漂白液等)
.(至少两种)已知:RX+Mg
RMgX (RX为卤代烃,X为卤族原子),生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下:(G的核磁共振氢谱有三组峰)
请按要求填空:
(1)3,4-二甲基-3-己醇是: (填代号),E的结构简式是
(2)C→E的反应类型是 ,F→G的反应类型是
(3)写出I→J化学反应方程式:
(4)A的同分异构体共有 种
(5)M为D的同分异构体且能发生银镜反应,写出所有M的结构简式 ;其中核磁共振氢谱中出现3组峰的物质与新制氢氧化铜悬浊液在煮沸条件下发生反应的方程式为: .
查看习题详情和答案>>
| 乙醚 |

现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下:(G的核磁共振氢谱有三组峰)

请按要求填空:
(1)3,4-二甲基-3-己醇是:
(2)C→E的反应类型是
(3)写出I→J化学反应方程式:
(4)A的同分异构体共有
(5)M为D的同分异构体且能发生银镜反应,写出所有M的结构简式
(2010?和平区一模)短周期元素a、b、c、d、e、f、g、h的原子序数依次增大,其中a和e、c和g、d和h同主族.b元素的最高正价和最低负价的绝对值之差为2;1mole单质能与冷水反应,在标准状况下生成11.2LH2;f原子最外层电子数等于其周期序数;h-的电子层结构与Ar原子相同.
(1)f原子结构示意图为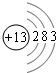
 ;d和e形成的化合物电子式为
;d和e形成的化合物电子式为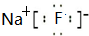
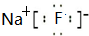 ;
;
(2)c和f简单离子的半径大小为
(3)元素非金属性强弱比较有很多方法,其中d和h的非金属性强弱的研究方案中不可行的是
①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较与H2反应的剧烈程度 ④比较最高价氧化物对应水合物的酸性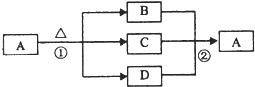
(4)如图是上述部分元素形成的化合物的转化关系图,已知B和D都是具有刺激性气味的气体,B是形成酸雨的污染物之一.
请按要求填空:
①化合物A的化学式
②写出②反应的化学方程式
查看习题详情和答案>>
(1)f原子结构示意图为


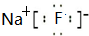
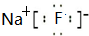
(2)c和f简单离子的半径大小为
O2->Al3+
O2->Al3+
;(用离子符号和“>”、“=”或“<”表示)(3)元素非金属性强弱比较有很多方法,其中d和h的非金属性强弱的研究方案中不可行的是
①④
①④
(填序号);①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较与H2反应的剧烈程度 ④比较最高价氧化物对应水合物的酸性

(4)如图是上述部分元素形成的化合物的转化关系图,已知B和D都是具有刺激性气味的气体,B是形成酸雨的污染物之一.
请按要求填空:
①化合物A的化学式
NH4HSO3
NH4HSO3
.②写出②反应的化学方程式
SO2+NH3+H2O=NH4HSO3
SO2+NH3+H2O=NH4HSO3
.中学化学常见的物质A、B、C、D之间存在如下转化关系:A+B→C+D+H2O(没有配平).请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体.C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:
a.BaCl2溶液 b.KMnO4溶液 c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的化学方程式是
(2)若A为红色金属单质,与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成经棕色.若被还原的B物质的量为2mol时,产生C气体的体积是
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一.C发生水解反应的离子方程式是
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体.检验A中阴离子的方法是
查看习题详情和答案>>
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体.C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
,鉴别这两种气体不能选用的试剂是
| ||
a
a
a.BaCl2溶液 b.KMnO4溶液 c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的化学方程式是
5NaOH+4CO2═Na2CO3+3NaHCO3+H2O
5NaOH+4CO2═Na2CO3+3NaHCO3+H2O
.此时溶液中的离子按照浓度由大到小排列的顺序是c(Na+)>c(HCO3-)>c(CO3 2- )>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO3 2- )>c(OH-)>c(H+)
.(2)若A为红色金属单质,与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成经棕色.若被还原的B物质的量为2mol时,产生C气体的体积是
44.8
44.8
L(标况).将生成的红棕色气体通入一个烧瓶里,塞紧瓶塞后,将烧瓶浸入冰水中,烧瓶中气体的颜色变浅,请用化学方程式和必要的文字解释颜色变化的原因2NO2(红棕色)?N2O4(无色);△H<0,降温,平衡向正反应方向移动,红棕色NO2浓度减小,混合气体的颜色变浅
2NO2(红棕色)?N2O4(无色);△H<0,降温,平衡向正反应方向移动,红棕色NO2浓度减小,混合气体的颜色变浅
.(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一.C发生水解反应的离子方程式是
ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体.检验A中阴离子的方法是
取少量A于一洁净试管中,加蒸馏水溶解后,滴加硝酸银溶液,产生白色没淀,再滴加稀硝酸,振荡,沉淀不溶解,则A的阴离子为Cl-
取少量A于一洁净试管中,加蒸馏水溶解后,滴加硝酸银溶液,产生白色没淀,再滴加稀硝酸,振荡,沉淀不溶解,则A的阴离子为Cl-
(简述操作过程及结论).