题目内容
(2010?和平区一模)短周期元素a、b、c、d、e、f、g、h的原子序数依次增大,其中a和e、c和g、d和h同主族.b元素的最高正价和最低负价的绝对值之差为2;1mole单质能与冷水反应,在标准状况下生成11.2LH2;f原子最外层电子数等于其周期序数;h-的电子层结构与Ar原子相同.
(1)f原子结构示意图为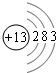
 ;d和e形成的化合物电子式为
;d和e形成的化合物电子式为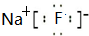
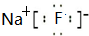 ;
;
(2)c和f简单离子的半径大小为
(3)元素非金属性强弱比较有很多方法,其中d和h的非金属性强弱的研究方案中不可行的是
①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较与H2反应的剧烈程度 ④比较最高价氧化物对应水合物的酸性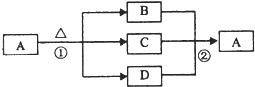
(4)如图是上述部分元素形成的化合物的转化关系图,已知B和D都是具有刺激性气味的气体,B是形成酸雨的污染物之一.
请按要求填空:
①化合物A的化学式
②写出②反应的化学方程式
(1)f原子结构示意图为


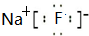
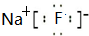
(2)c和f简单离子的半径大小为
O2->Al3+
O2->Al3+
;(用离子符号和“>”、“=”或“<”表示)(3)元素非金属性强弱比较有很多方法,其中d和h的非金属性强弱的研究方案中不可行的是
①④
①④
(填序号);①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较与H2反应的剧烈程度 ④比较最高价氧化物对应水合物的酸性

(4)如图是上述部分元素形成的化合物的转化关系图,已知B和D都是具有刺激性气味的气体,B是形成酸雨的污染物之一.
请按要求填空:
①化合物A的化学式
NH4HSO3
NH4HSO3
.②写出②反应的化学方程式
SO2+NH3+H2O=NH4HSO3
SO2+NH3+H2O=NH4HSO3
.分析:短周期元素a、b、c、d、e、f、g、h的原子序数依次增大.1mole单质能与冷水反应,在标准状况下生成11.2LH2,反应中e表现+1价,处于第ⅠA族,a和e同主族,由二者原子序数相差可知,e为Na元素,a为H元素或Li元素;b元素的最高正价和最低负价的绝对值之差为2,则b最外层有5个电子,处于第ⅤA族,原子序数较Na小,故b为氮元素;f处于第三周期,f原子最外层电子数等于其周期序数,故f为铝元素;h-的电子层结构与Ar原子相同,h为氯元素,d和h同主族,故d为氟元素;c的原子序数介于氮元素与氟元素之间,故c为氧元素,c和g同主族,故g为硫元素,
(1)f为铝元素,铝原子核外有13个电子,有3个电子层,最外层电子数为3;
NaF是离子化合物,由钠离子与氟离子构成;
(2)核外电子层结构相同,核电荷数越大离子半径越小;
(3))①颜色属于物理性质,不能比较非金属性强弱;
②非金属越强,气态氢化物越稳定;
③与H2反应的剧烈程度,说明单质的氧化性越强,元素的非金属性越强;
④F元素没有含氧酸;
(4)由上述部分元素形成的化合物,由转化关系可知,考虑A为弱酸酸式铵盐,B和D都是具有刺激性气味的气体,B是形成酸雨的污染物之一,应为SO2,D为NH3,C为H2O,A为NH4HSO3.
(1)f为铝元素,铝原子核外有13个电子,有3个电子层,最外层电子数为3;
NaF是离子化合物,由钠离子与氟离子构成;
(2)核外电子层结构相同,核电荷数越大离子半径越小;
(3))①颜色属于物理性质,不能比较非金属性强弱;
②非金属越强,气态氢化物越稳定;
③与H2反应的剧烈程度,说明单质的氧化性越强,元素的非金属性越强;
④F元素没有含氧酸;
(4)由上述部分元素形成的化合物,由转化关系可知,考虑A为弱酸酸式铵盐,B和D都是具有刺激性气味的气体,B是形成酸雨的污染物之一,应为SO2,D为NH3,C为H2O,A为NH4HSO3.
解答:解:短周期元素a、b、c、d、e、f、g、h的原子序数依次增大.1mole单质能与冷水反应,在标准状况下生成11.2LH2,反应中e表现+1价,处于第ⅠA族,a和e同主族,由二者原子序数相差可知,e为Na元素,a为H元素或Li元素;b元素的最高正价和最低负价的绝对值之差为2,则b最外层有5个电子,处于第ⅤA族,原子序数较Na小,故b为氮元素;f处于第三周期,f原子最外层电子数等于其周期序数,故f为铝元素;h-的电子层结构与Ar原子相同,h为氯元素,d和h同主族,故d为氟元素;c的原子序数介于氮元素与氟元素之间,故c为氧元素,c和g同主族,故g为硫元素,
(1)f为铝元素,铝原子核外有13个电子,有3个电子层,最外层电子数为3,原子结构示意图为 ;
;
d为氟元素、e为钠元素,d和e形成的化合物是NaF,NaF是离子化合物,由钠离子与氟离子构成,电子式为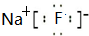 .
.
故答案为: ;
;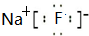 ;
;
(2)c为氧元素、f为铝元素,二者形成的简单离子核外电子结构相同,核电荷数越大,离子半径越小,所以离子半径O2->Al3+,故答案为:O2->Al3+;
(3)①颜色属于物理性质,不能比较非金属性强弱,故①错误;
②非金属越强,气态氢化物越稳定,可以比较非金属性强弱,故②正确;
③与H2反应的剧烈程度,说明单质的氧化性越强,元素的非金属性越强,可以比较非金属性强弱,故③正确;
④F元素没有含氧酸,故④错误;
故选:①④;
(4)由上述部分元素形成的化合物,由转化关系可知,考虑A为弱酸酸式铵盐,B和D都是具有刺激性气味的气体,B是形成酸雨的污染物之一,应为SO2,D为NH3,C为H2O,A为NH4HSO3,
①化合物A的化学式为:NH4HSO3,故答案为:NH4HSO3;
②、反应②的化学方程式为:SO2+NH3+H2O=NH4HSO3,故答案为:SO2+NH3+H2O=NH4HSO3.
(1)f为铝元素,铝原子核外有13个电子,有3个电子层,最外层电子数为3,原子结构示意图为
 ;
;d为氟元素、e为钠元素,d和e形成的化合物是NaF,NaF是离子化合物,由钠离子与氟离子构成,电子式为
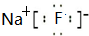 .
.故答案为:
 ;
;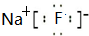 ;
;(2)c为氧元素、f为铝元素,二者形成的简单离子核外电子结构相同,核电荷数越大,离子半径越小,所以离子半径O2->Al3+,故答案为:O2->Al3+;
(3)①颜色属于物理性质,不能比较非金属性强弱,故①错误;
②非金属越强,气态氢化物越稳定,可以比较非金属性强弱,故②正确;
③与H2反应的剧烈程度,说明单质的氧化性越强,元素的非金属性越强,可以比较非金属性强弱,故③正确;
④F元素没有含氧酸,故④错误;
故选:①④;
(4)由上述部分元素形成的化合物,由转化关系可知,考虑A为弱酸酸式铵盐,B和D都是具有刺激性气味的气体,B是形成酸雨的污染物之一,应为SO2,D为NH3,C为H2O,A为NH4HSO3,
①化合物A的化学式为:NH4HSO3,故答案为:NH4HSO3;
②、反应②的化学方程式为:SO2+NH3+H2O=NH4HSO3,故答案为:SO2+NH3+H2O=NH4HSO3.
点评:本题考查结构性质位置关系、无机物推断、常用化学用语律等,难度中等,推断元素是解题的关键,全面掌握基础知识.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
 (2010?和平区一模)阿斯巴甜(Aspartame)具有清爽的甜味,甜度约为蔗糖的200倍.有关说法不正确的是( )
(2010?和平区一模)阿斯巴甜(Aspartame)具有清爽的甜味,甜度约为蔗糖的200倍.有关说法不正确的是( )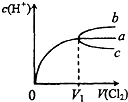 (2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )
(2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )