网址:http://m.1010jiajiao.com/timu3_id_376359[举报]
以电石渣(主要成分是Ca(OH)2,含SiO2以及其它少量杂质)为原料生产氯酸钾联合生产碳酸钙的流程如下:
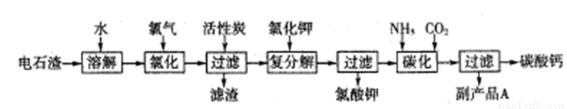
回答下列问题:
(1)电石渣溶于水形成电石渣浆时发生的主要反应的化学方程式为:????????????
(2)氯化过程的温度控制在75~80℃,该过程主要反应的离子方程式为:?????????
(3)该流程中加入活性炭的作用是??????????????????????????
(4)碳化过程中,先向溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。
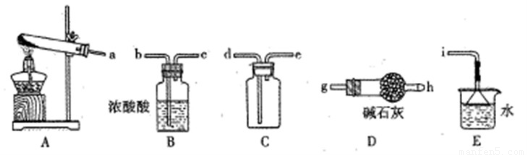
如果按气流方向连接各仪器接口,你认为正确的顺序为a→ ? ? 、????? → ???? 、????? →i。其中与i相连漏斗的作用是?? ????????????? 。
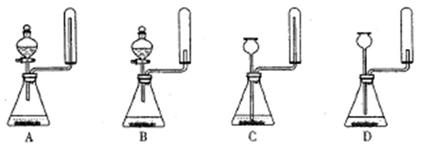
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是 ??? ?? (填编号)

(5)副产品A的化学式为 ????????? 。
查看习题详情和答案>>
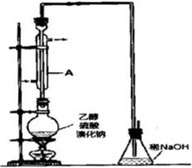
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应.
请问答下列问题.
(1)装置A的作用是______.
(2)反应时若温度过高,则有SO2生成,同时观察到还有一种红棕色气体产生,该气体的分子式是______.
(3)反应结束后,得到的粗产品呈棕黄色.为了除去粗产品中的杂质,可选择下列试剂中的______(填写上正确选项的字母).
a.稀氢氧化钠溶液 b.乙醇 c.四氯化碳
(4)(3)中实验操作中所需的主要玻璃仪器是______(填仪器名称).
(5)要进一步制得纯净的溴乙烷,司继续用蒸馏水洗涤,分液后,再加入无水CaCl2,然后进行的实验操作是______(填写正确选项的字母).
a.分液 b.蒸馏 c.萃取
(6)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后______(按实验的操作顺序选填下列序号).
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液.
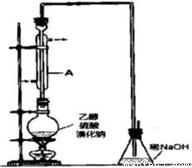
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应.
请问答下列问题.
(1)装置A的作用是 .
(2)反应时若温度过高,则有SO2生成,同时观察到还有一种红棕色气体产生,该气体的分子式是 .
(3)反应结束后,得到的粗产品呈棕黄色.为了除去粗产品中的杂质,可选择下列试剂中的 (填写上正确选项的字母).
a.稀氢氧化钠溶液 b.乙醇 c.四氯化碳
(4)(3)中实验操作中所需的主要玻璃仪器是 (填仪器名称).
(5)要进一步制得纯净的溴乙烷,司继续用蒸馏水洗涤,分液后,再加入无水CaCl2,然后进行的实验操作是 (填写正确选项的字母).
a.分液 b.蒸馏 c.萃取
(6)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后 (按实验的操作顺序选填下列序号).
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液.
 查看习题详情和答案>>
查看习题详情和答案>>
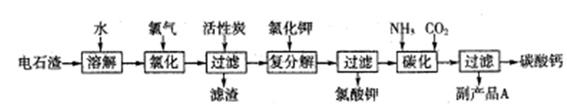
回答下列问题:
(1)电石渣溶于水形成电石渣浆时发生的主要反应的化学方程式为:
(2)氯化过程的温度控制在75~80℃,该过程主要反应的离子方程式为:
(3)该流程中加入活性炭的作用是
(4)碳化过程中,先向溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。

如果按气流方向连接各仪器接口,你认为正确的顺序为a→ 、 → 、 →i。其中与i相连漏斗的作用是 。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是 (填编号)
(5)副产品A的化学式为 。
(16分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含少量K+、Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、 75%乙醇、四氯化碳;欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42—离子,选出a所代表的试剂,按滴加顺序依次是 (只填化学式)。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒、托盘天平、烧杯还需要 (填仪器名称);若定容时仰视刻度线,则所配溶液的浓度 (填“偏大”、“偏小”或“无影响”)。
(3)在电解饱和食盐水的实验中,若收集的H2为3.36 L(在标准状况下),则转移电子的个数为 ,同样条件下收集的Cl2 (填“>”、“=”或“<”)3.36 L。
(4)实验室制备Cl2通常采用二氧化锰与浓盐酸共热来制取,发生反应的离子方程式为: ;
据此,从下列所给仪器装置中选择制备并收集干燥、纯净Cl2的装置 (填代号)
可选用制备气体的装置:
所选装置中的两个洗气瓶里应依次盛装 、 (填试剂的名称),请结合化学平衡移动原理解释第一个洗气瓶中试剂选择的理由 ;尾气用 溶液(填化学式)吸收,写出发生反应的离子方程式 。
查看习题详情和答案>>