摘要:.3.Cu(OH)2
网址:http://m.1010jiajiao.com/timu3_id_375655[举报]
下列说法正确的是
A.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液
B.可利用反应2CO=2C+O2( H>O、
H>O、 S<0)来消除CO污染
S<0)来消除CO污染
C.若弱酸HA的酸性强于弱酸HB,则相同物质的量浓度的钠盐溶液的碱性:NaA<NaB
D.除去Cu粉中混有的CuO,可将混合物加入稀硝酸中,充分反应后过滤、洗涤
查看习题详情和答案>>
下列说法正确的是
| A.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液 |
B.可利用反应2CO=2C+O2(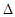 H>O、 H>O、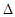 S<0)来消除CO污染 S<0)来消除CO污染 |
| C.若弱酸HA的酸性强于弱酸HB,则相同物质的量浓度的钠盐溶液的碱性:NaA<NaB |
| D.除去Cu粉中混有的CuO,可将混合物加入稀硝酸中,充分反应后过滤、洗涤 |
下列说法正确的是
- A.可利用反应2CO═2C+O2(△H>0,△S<0)来消除CO污染
- B.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液
- C.由“同温度下等物质的量浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱
- D.除去Cu粉中混有的CuO,可将混合物加入稀硝酸中,充分反应后过滤、洗涤
下列说法正确的是
| A.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液 |
B.可利用反应2CO=2C+O2(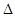 H>O、 H>O、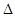 S<0)来消除CO污染 S<0)来消除CO污染 |
| C.若弱酸HA的酸性强于弱酸HB,则相同物质的量浓度的钠盐溶液的碱性:NaA<NaB |
| D.除去Cu粉中混有的CuO,可将混合物加入稀硝酸中,充分反应后过滤、洗涤 |
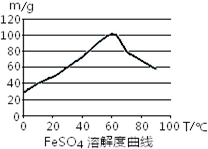 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.(1)用铁屑与稀硫酸反应制备FeSO4
①制备原理用离子方程式表示为
FeSO4生成速率,采取下列措施中正确的是
A.使用浓硫酸与铁屑反应
B.使用磨细的铁粉反应
C.控制温度在50~70℃
D.控制温度在80~100℃
②在上述反应过程中,常会伴随发生反应:4Fe2++O2+4H+?4Fe3++2H2O
若要减少产品FeSO4中Fe3+的含量,采取下列措施中正确的是
A.控制稀硫酸的浓度不能太高
B.用去O2蒸馏水注入浓硫酸配制反应所需的稀硫酸
C.反应中保持n(Fe)/n(H2SO4)>1
D.反应中应经常添加Fe2(SO4)3搅拌
③反应结束后,将溶液进行
(2)工业上用含有少量Cu、Al的废铁屑制备Fe2(SO4)3
其反应及操作流程如下:
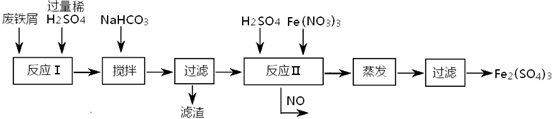
①加入NaHCO3并搅拌,将混合液pH调控至
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
③生产中,将反应Ⅱ产生的NO配比一种气体X,混合后重新通入反应Ⅱ中,该设计的目的是
(3)用Fe2(SO4)3处理含S2-污水时,有黑色沉淀及淡黄色悬浮物产生,其反应的离子方程式是