摘要:⑴2H2+CO2→2H2O+C ⑵10 ⑶ ①分液漏斗 烧瓶 ②盐酸 ③防止水解 ④c g⑤
网址:http://m.1010jiajiao.com/timu3_id_375650[举报]
 “氢”既是重要的化工原料,也是未来最理想的新能源.
“氢”既是重要的化工原料,也是未来最理想的新能源.(1)①实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量.则氢气燃烧生成H2O(g)的热化学方程式为
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
.②熔融碳酸盐燃料电池(MCFS)是使用熔融碳酸锂、碳酸钾作电解质的一种新型电池,该电池的工作温度为650℃.负极由镍铬铝合金烧结而成,正极材料为多孔镍,电池反应为:H2+CO+O2=CO2+H2O.下列说法不正确的是
AB
AB
A.负极反应Al-3e-=Al3+ B.燃料气体是氧气
C.正极反应为2CO2+O2+4e-=2CO32- D.该电池也可用烃类作燃料
(2)用CO2和氢气为原料,在催化剂作用下发生如下反应,
2CO2(g)+6H2(g)
| 催化剂 |
①该反应的平衡常数表达式K=
| c(CH3CH2OH).C3(H2O) |
| C2(CO2).C6(H2) |
| c(CH3CH2OH).C3(H2O) |
| C2(CO2).C6(H2) |
②在一定压强下,
| n(H2) |
| n(CO2) |
| 温度(K) | 500 | 600 | 700 | 800 |
| CO2转化率(%) | 60 | 43 | 28 | 15 |
减小
减小
(填“增大”、“减小”或“不变”);上述反应的焓变△H<
<
0(填“>”、“<”或“=”).③其它条件不变,适当提高c(CO2),则乙醇的产量
增大
增大
(填“增大”、“减小”或“不变”,下同.),此时K值不变
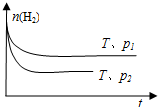
不变
.④在一定温度下,H2的物质的量随时间的变化曲线如图,则p1
<
<
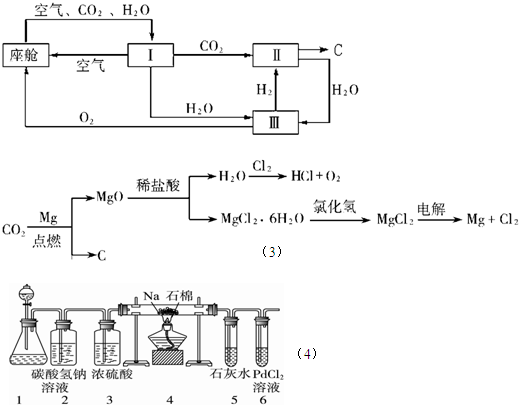
p2(填“>”、“<”或“=”).(2010?平顶山模拟)航天飞行器座舱内空气更新过程如下图所示:
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式为
(2)从装置Ⅰ、Ⅱ、Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28mol O2,呼出23mol CO2,则宇航员每天呼出的气体中含H2O
(3)以下是另一种将CO2转化为O2的实验设想:上述设想优点是:①吸收航天器中宇航员排出的二氧化碳气体同时产生氧气以供呼吸;②
(4)某同学根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧.为了确定其生成产物并进行实验论证,请你参与以下研究过程.该同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题:
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:
③指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有碳:
查看习题详情和答案>>
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式为
2H2+CO2=2H2O+C
2H2+CO2=2H2O+C
.(2)从装置Ⅰ、Ⅱ、Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28mol O2,呼出23mol CO2,则宇航员每天呼出的气体中含H2O
10
10
mol.(3)以下是另一种将CO2转化为O2的实验设想:上述设想优点是:①吸收航天器中宇航员排出的二氧化碳气体同时产生氧气以供呼吸;②
生成的Mg和Cl2可以循环利用
生成的Mg和Cl2可以循环利用
.(4)某同学根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧.为了确定其生成产物并进行实验论证,请你参与以下研究过程.该同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题:
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:
2Na+2CO2=Na2CO3+CO
2Na+2CO2=Na2CO3+CO
.②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:
4Na+3CO2=2Na2CO3+C
4Na+3CO2=2Na2CO3+C
.③指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有碳:
将4中固体加足量水,有不溶黑色固体,则生成物中有C
将4中固体加足量水,有不溶黑色固体,则生成物中有C
.
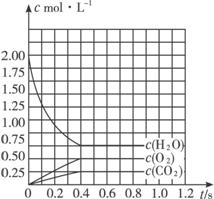
一定条件下,将2 mol H2O(g)和2 mol CO充入容积固定的1 L密闭容器中,加热至高温,发生下列可逆反应:
2H2O(g)![]() 2H2(g)+O2(g);2CO(g)+O2(g)
2H2(g)+O2(g);2CO(g)+O2(g)![]() 2CO2(g)。
2CO2(g)。
请回答下列问题:
(1)当容器内的压强不再发生改变时,测知下列各项中提供的气体的浓度即可求出该条件下混合气体平衡组成的是____________(填序号)。
A.c(H2O)、c(H2) B.c(H2)、c(CO2)
C.c(CO2)、c(O2) D.c(CO)、c(CO2)
(2)在相同条件下,改变起始气体的投放量,亦可实现(1)中混合气体的平衡组成。例如:________________________________;________________________________。(填写两种情况)
(3)请在下图中,画出反应过程中c(O2)的变化曲线。
|
|
|
|
⑤2Na+Cl2===2NaCl; ⑥2CuO+C===2Cu+CO2↑
A、②③④⑤ B、①②④⑤⑥ C、①②③④⑤ D、全部
查看习题详情和答案>> (2011?南开区一模)能源开发、环境保护、资源利用等是当今社会的热门话题.请根据所学化学知识回答下列问题:
(2011?南开区一模)能源开发、环境保护、资源利用等是当今社会的热门话题.请根据所学化学知识回答下列问题:(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ?mol-1;
2C(s)+O2(g)=2CO(g)△H=-221.0kJ?mol-1;
C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
则尾气转化反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H=
-746.5kJ?mol-1
-746.5kJ?mol-1
.(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动.
下列说法中正确的是
ABD
ABD
(填字母序号).A.负极的电极反应式为:CO+O2--2e-=CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移
D.传感器中通过的电流越大,尾气中CO的含量越高
(3)某硝酸厂利用甲醇处理废水.在一定条件下,向废水中加入CH3OH,将HNO3还原成N2.若该反应消耗32g CH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比为
5:6
5:6
.(4)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇.若在一定温度下,向1L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)?CH3OH(g),经10min反应达到平衡时测得各组分的浓度如下:
| 物 质 | CO | H2 | CH3OH |
| 浓度/(mol?L-1) | 1.2 | 1.0 | 0.6 |
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
0.12mol/(L?min)
0.12mol/(L?min)
.③平衡时CO的转化率为33.3%
33.3%
(保留1位小数).