摘要:2.0.03mol铜完全溶于硝酸.产生氮的氧化物NO.NO2.N2O4混合气体共0.05mol. 该混合气体的平均相对分子质量可能是 A. 30 B. 46 C. 50 D. 66
网址:http://m.1010jiajiao.com/timu3_id_375241[举报]
将一定量的Na、Al合金置于水中,结果合金完全溶解,得到20 mLpH=14的溶液.然后用1 mol·L-1的盐酸滴定至沉淀量最大时,消耗40 mL盐酸,原合金中Na的物质的量是
- A.0.01 mol
- B.0.02 mol
- C.0.03 mol
- D.0.04 mol
为测定含有Na2O杂质的Na2O2样品的纯度,甲、乙、丙三位同学设计了不同的方案.
甲:用图l所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.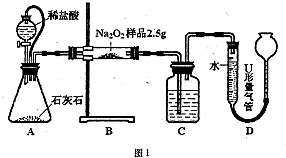
(1)C中所盛的药品是
(2)A中橡皮管的作用是
(3)利用该实验方案所测Na2O2的纯度明显偏大,其原因可能是
a.装置A、B中的空气对测定结果产生了影响
b.装置C中的空气对测定结果产生了影响
c.读数时U形量气管中的液面左高右低
d.读数时U形量气管中的液面左低右高
乙、丙两同学在研究Na2O2与水反应的实验时,观察到以下实验现象:Na2O2与水反应,放出大量的热,产生大量气体;反应后的溶液中滴入几滴酚酞,溶液先变红,振荡后又褪色;再往溶液中加入少许Mn02:粉末,又产生大量气体;当不再产生气体时,再滴加几滴酚酞,溶液又变红,且振荡后不褪色.分析了这些实验现象后,他们分别设计了如下方案.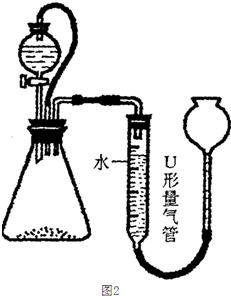
乙:用图2所示装置,称取2.5g样品,测得与水反应生成氧气的体积为112mL(标准状况),然后将溶液先用硫酸中和,再用0.2mol/L KMn04酸性溶液滴定,消耗KMn04酸性溶液30mL(已知:滴定过程中生成了Mn2+和氧气).
(4)滴定过程中发生反应的离子方程式为
(5)滴定终点的颜色变化为
(6)计算Na2O2样品的纯度是:
×100%=78%
×100%=78%.
查看习题详情和答案>>
甲:用图l所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.

(1)C中所盛的药品是
NaOH溶液
NaOH溶液
(2)A中橡皮管的作用是
起恒压作用,使盐酸容易滴下;避免盐酸排空气使氧气体积偏大
起恒压作用,使盐酸容易滴下;避免盐酸排空气使氧气体积偏大
(3)利用该实验方案所测Na2O2的纯度明显偏大,其原因可能是
ac
ac
(填选项字母).a.装置A、B中的空气对测定结果产生了影响
b.装置C中的空气对测定结果产生了影响
c.读数时U形量气管中的液面左高右低
d.读数时U形量气管中的液面左低右高
乙、丙两同学在研究Na2O2与水反应的实验时,观察到以下实验现象:Na2O2与水反应,放出大量的热,产生大量气体;反应后的溶液中滴入几滴酚酞,溶液先变红,振荡后又褪色;再往溶液中加入少许Mn02:粉末,又产生大量气体;当不再产生气体时,再滴加几滴酚酞,溶液又变红,且振荡后不褪色.分析了这些实验现象后,他们分别设计了如下方案.

乙:用图2所示装置,称取2.5g样品,测得与水反应生成氧气的体积为112mL(标准状况),然后将溶液先用硫酸中和,再用0.2mol/L KMn04酸性溶液滴定,消耗KMn04酸性溶液30mL(已知:滴定过程中生成了Mn2+和氧气).
(4)滴定过程中发生反应的离子方程式为
2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
(5)滴定终点的颜色变化为
溶液由无色变紫红色
溶液由无色变紫红色
(6)计算Na2O2样品的纯度是:
(0.2×0.03×
| ||||
| 2.5g |
(0.2×0.03×
| ||||
| 2.5g |
(2010?杭州一模)海水中含有多种盐类物质,在一定温度下将海水不断浓缩,其间会不断有晶体析出,且海水的密度逐渐增大,下表为一定温度下不同密度的海水中几种盐类的含量(g/mL)
回答下列问题:
(1)在该温度下恒温蒸发海水时,海水的密度从1.13g/mL增大到1.21g/mL时是否有硫酸钙析出?
(2)恒温下,当蒸发1m3密度为1.22g/mL的海水达到密度为1.26g/mL时,析出MgSO4的质量为
查看习题详情和答案>>
| 海水密度(g/mL) | CaSO4 (g/L) |
NaCl (g/L) |
MgCl2 (g/L) |
MgSO4 (g/L) |
NaBr (g/L) |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
(1)在该温度下恒温蒸发海水时,海水的密度从1.13g/mL增大到1.21g/mL时是否有硫酸钙析出?
是
是
(2)恒温下,当蒸发1m3密度为1.22g/mL的海水达到密度为1.26g/mL时,析出MgSO4的质量为
0.03
0.03
kg,析出NaCl的质量为8.33
8.33
kg.在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
| A、v(H2)=0.03 mol/(L?min) | B、v(N2)=0.02 mol/(L?min) | C、v(NH3)=0.17 mol/(L?min) | D、v(NH3)=0.01 mol/(L?min) |
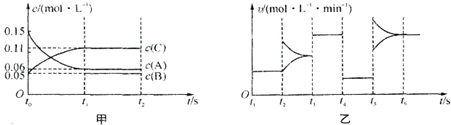
向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示(t0~t1)阶段的c(B)变化未画出.乙图为
时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,t3~t4阶段为使用催化剂.下列说法中不正确的是( )
| t | 2 |

| A、若t0=15 s,则用C的浓度变化表示的t0~t1段的平均反应速率为0.004mol?L-1?s-1 |
| B、t4~t5阶段改变的条件一定为减小压强 |
| C、该容器的容积为2 L,B的起始物质的量为0.02 mol |
| D、t5~t6如阶段,容器内A的物质的量减少了0.03 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式为3A(g)?B(g)+2C(g)△H=+100akJ?mol-1 |