摘要:某同学对离子方程式:xR2++yH++O2 == mR3++nH2O作出的下列结论.正确的是( ) A.根据电荷守恒:x+y = m B.根据电子得失守恒:x=2 C.根据原子守恒:x=m D.根据质量守恒:x+y+1=n+m
网址:http://m.1010jiajiao.com/timu3_id_374700[举报]
①~⑩是元素周期表中的十种元素:
回答下列问题:
(1)某同学对下列性质进行了对比,其中正确的是
A.原子半径:⑩>⑨>⑦
B.离子半径:⑨>④>⑦
C.非金属性:③>②>⑥
D.单质的熔点:④>⑨>⑩>⑧
E.单质的氧化性:③>⑦>⑧
(2)用合适的化学用语回答:
金属性最强的元素离子结构示意图为
 ,常温下呈液态的氢化物的结构式为:
,常温下呈液态的氢化物的结构式为:
(3)在上述元素中,②、⑧元素形成的气态氢化物可以相互反应,该反应的化学方程式为
查看习题详情和答案>>
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(1)某同学对下列性质进行了对比,其中正确的是
CD
CD
.A.原子半径:⑩>⑨>⑦
B.离子半径:⑨>④>⑦
C.非金属性:③>②>⑥
D.单质的熔点:④>⑨>⑩>⑧
E.单质的氧化性:③>⑦>⑧
(2)用合适的化学用语回答:
金属性最强的元素离子结构示意图为


H-O-H
H-O-H
.(3)在上述元素中,②、⑧元素形成的气态氢化物可以相互反应,该反应的化学方程式为
NH3+HCl═NH4Cl
NH3+HCl═NH4Cl
;⑨、⑤元素形成的最高价氧化物的水化物可以相互反应,该反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O
Al(OH)3+OH-═AlO2-+2H2O
. 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”.由化学手册查阅得有关物质的熔、沸点数据如下表.
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”.由化学手册查阅得有关物质的熔、沸点数据如下表.| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 |
合理
合理
(填“合理”或“不合理”).(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
NaOH溶液
NaOH溶液
,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.取一定量该熔融物与足量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐渐滴加4mol?L-1 NaOH溶液,所加NaOH溶液的体积V(NaOH)与产生沉淀的物质的量n(沉淀)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生的离子方程式为:
H++OH-=H2O
H++OH-=H2O
.(2)在DE段沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:
NH4++OH-═NH3?H2O
NH4++OH-═NH3?H2O
.(3)由上述图象分析可知,溶液中离子结合OH-的能力由强到弱的顺序是
H+>Fe3+>Al3+>NH4+
H+>Fe3+>Al3+>NH4+
.(用离子符号表示)(4)B与A的差值
0.008
0.008
mol.(5)B点对应的沉淀的物质的量为
0.032
0.032
mol,C点对应的溶液体积为7
7
mL.下列是某同学对相应反应的方程式所作的评价,其中评价合理的是( )
|
| A、A | B、B | C、C | D、D |
如表是某同学对相应反应的离子方程式所作的评价,其中评价完全合理的是( )
|
查看习题详情和答案>>
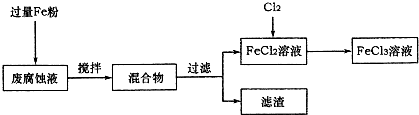
印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.
(1)测得某废腐蚀液中含CuCl2 1.5mol?L-1、FeCl23.0 mol?L-1、FeCl3 1.0mol?L-1、HCl3.0mol?L-1.取废腐蚀液200mL按如下流程在实验室进行实验:
回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为
②检验废腐蚀液中含有Fe3+的实验操作是
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、
③由滤渣得到纯铜,除杂所需试剂是
(2)某化学兴趣小组利用如图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液.
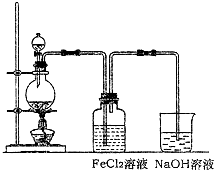
①实验开始前,某同学对实验装置进行了气密性检查,方法是
②浓盐酸与二氧化锰反应的化学方程式为
烧杯中NaOH溶液的作用是
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于
查看习题详情和答案>>
(1)测得某废腐蚀液中含CuCl2 1.5mol?L-1、FeCl23.0 mol?L-1、FeCl3 1.0mol?L-1、HCl3.0mol?L-1.取废腐蚀液200mL按如下流程在实验室进行实验:

回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2H++Fe=Fe2++H2↑
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2H++Fe=Fe2++H2↑
;②检验废腐蚀液中含有Fe3+的实验操作是
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
;在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、
漏斗
漏斗
.③由滤渣得到纯铜,除杂所需试剂是
盐酸
盐酸
.(2)某化学兴趣小组利用如图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液.

①实验开始前,某同学对实验装置进行了气密性检查,方法是
关闭分液漏斗活塞,将导管插入水中,用手捂热烧瓶,导管口有气泡冒出,松开手导管内出现一段水柱,证明气密性良好
关闭分液漏斗活塞,将导管插入水中,用手捂热烧瓶,导管口有气泡冒出,松开手导管内出现一段水柱,证明气密性良好
.②浓盐酸与二氧化锰反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
;
| ||
烧杯中NaOH溶液的作用是
吸收多余氯气,防止尾气处理
吸收多余氯气,防止尾气处理
.③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于
39.2
39.2
g,需通入Cl2的物质的量应不少于0.75
0.75
mol.