摘要:26.判断下列实验操作或对实验事实的叙述中正确的是 A.用托盘天平称取10.50 g干燥的NaCl固体. B.中和热的测定所需的玻璃仪器只有烧杯.量筒. C.采取降温结晶可以提纯混有少量氯化钾的硝酸钾. D.测定烧杯中溶液的pH时.用pH试纸直接在烧杯中蘸取溶液. E.配制浓硫酸和浓硝酸的混合酸时.将浓硫酸沿器壁慢慢加入到浓硝酸中.并不断搅拌. F.实验室配制氯化亚铁溶液时.将氯化亚铁先溶解在盐酸中.然后用蒸馏水稀释并加入少量铁粉. G.配制一定浓度的溶液时.若定容时不小心加水超过容量瓶的刻度线.应立即用滴管吸去多余的部分.
网址:http://m.1010jiajiao.com/timu3_id_374467[举报]
化合物A、B、C和D互为同分异构体,相对分子质量不超过150,分子中只含碳、氢、氧三种元素,其中氧的含量为23.5%.实验表明:化合物A、B、C和D均是一取代芳香化合物,其中A、C和D的苯环侧链上只含一个官能团,B能发生银镜反应,4种化合物在碱性条件下可以发生如下反应:
A
E(C7H6O2)+F
B
G(C7H8O)+H
C
I(芳香化合物)+J
D
K+H2O
试回答下列问题:
(1)A的相对分子质量是
(2)H的结构简式为
 ,I的结构简式为
,I的结构简式为
 ;
;
(3)判断下列反应的反应类型:①
(4)现有如下溶液:NaOH、NaHCO3,、饱和溴水、FeCl?和NHCl.从中选择合适试剂,设计一种实验方案鉴别E、G和I:
查看习题详情和答案>>
A
| NaOH溶液 |
| ① |
| H+ |
| ② |
B
| ||
| ③ |
| ||
| ④ |
C
| ||
| ⑤ |
| ||
| ⑥ |
D
| ||
| ⑦ |
试回答下列问题:
(1)A的相对分子质量是
136
136
,C的分子式是C8H8O2
C8H8O2
;(2)H的结构简式为
HCOOH
HCOOH
,B的结构简式为



(3)判断下列反应的反应类型:①
水解反应
水解反应
,⑦酸碱中和
酸碱中和
;(4)现有如下溶液:NaOH、NaHCO3,、饱和溴水、FeCl?和NHCl.从中选择合适试剂,设计一种实验方案鉴别E、G和I:
取三只试管,各加2mL水,分别将少许E、G、I加入试管中,再各加入1-2滴氯化铁溶液,呈现蓝紫色的试管中的化合物是苯酚I;
另取两只试管,各加适量氢氧化钠溶液,分别将E和G加入试管中,充分振荡后,不溶于氢氧化钠溶液的化合物为苯甲醇G,溶于氢氧化钠溶液的化合物是苯甲酸E
另取两只试管,各加适量氢氧化钠溶液,分别将E和G加入试管中,充分振荡后,不溶于氢氧化钠溶液的化合物为苯甲醇G,溶于氢氧化钠溶液的化合物是苯甲酸E
取三只试管,各加2mL水,分别将少许E、G、I加入试管中,再各加入1-2滴氯化铁溶液,呈现蓝紫色的试管中的化合物是苯酚I;
另取两只试管,各加适量氢氧化钠溶液,分别将E和G加入试管中,充分振荡后,不溶于氢氧化钠溶液的化合物为苯甲醇G,溶于氢氧化钠溶液的化合物是苯甲酸E
.另取两只试管,各加适量氢氧化钠溶液,分别将E和G加入试管中,充分振荡后,不溶于氢氧化钠溶液的化合物为苯甲醇G,溶于氢氧化钠溶液的化合物是苯甲酸E
Ⅰ.从海水得到的粗食盐水中常含Ca2+、Mg2+、S
,需要分离提纯.现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸;②Na2CO3;③NaOH;④BaCl2来除去食盐水中Ca2+、Mg2+、
.提纯的操作步骤和加入试剂的情况如图:图中a、b、c、d分别表示上述4种试剂中的一种,试回答:
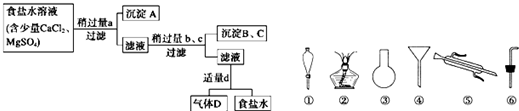
(1)沉淀A的名称是
(2)试剂d是
(3)现有下列仪器,过滤出沉淀A、B、C时必须用到
Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的一部分,则正确的是
Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的
查看习题详情和答案>>
| O | 2- 4 |
| O | 2- 4 |

(1)沉淀A的名称是
硫酸钡
硫酸钡
;(2)试剂d是
盐酸
盐酸
;判断试剂d已经足量的方法是溶液中不会再产生气体
溶液中不会再产生气体
;(3)现有下列仪器,过滤出沉淀A、B、C时必须用到
④
④
(填序号),仪器③的名称是圆底烧瓶
圆底烧瓶
.Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的一部分,则正确的是
②⑤⑥
②⑤⑥
(填序号).Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的
①
①
(填序号),该仪器名称为分液漏斗
分液漏斗
,向该碘水中加入四氯化碳以提取碘单质的实验操作为萃取
萃取
.【必考题】
过氧化尿素[CO(NH2)2?H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域.其合成如下:

试回答下列问题:
(1)实际生产中需控制n(H2O2):n(CO(NH2)2)]=1.2:1,并控制合成温度在25-30℃,其主要原因是
(2)从母液中分离出H2O2和尿素,采用的操作是
(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容.准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000mol/L KMnO4 标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应).
①KMnO4溶液应盛放在
②完成并配平方程式:
③根据滴定结果,可确定产品中活性氧的质量分数为:
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量
⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为
查看习题详情和答案>>
过氧化尿素[CO(NH2)2?H2O2]是一种无毒、无味的白色结晶粉末,具有尿素和过氧化氢双重性质,是一种新型的氧化剂和消毒剂,广泛应用于漂白、纺织、医药、农业、养殖业等领域.其合成如下:

试回答下列问题:
(1)实际生产中需控制n(H2O2):n(CO(NH2)2)]=1.2:1,并控制合成温度在25-30℃,其主要原因是
H2O2在实验过程中会有部分分解,增大过氧化氢的量可提高过氧化尿素的纯度
H2O2在实验过程中会有部分分解,增大过氧化氢的量可提高过氧化尿素的纯度
.(2)从母液中分离出H2O2和尿素,采用的操作是
c
c
.(a)盐析 过滤 (b)分液 过滤 (c)减压蒸馏 结晶 (d)常压蒸馏 萃取
(3)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品12.000g,溶解,在250mL容量瓶中定容.准确量取25.00mL于锥形瓶中,加入1mL 6mol/L的硫酸,然后用0.2000mol/L KMnO4 标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液20.00mL(KMnO4溶液与尿素不反应).
①KMnO4溶液应盛放在
酸
酸
式(选填:“酸”、“碱”)滴定管中.②完成并配平方程式:
2
2
MnO4-+5
5
H2O2+6
6
H+=2
2
Mn2++8
8
H2O+5O2
5O2
③根据滴定结果,可确定产品中活性氧的质量分数为:
13.3%
13.3%
.④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量
偏高
偏高
(选填:“偏高”、“偏低”或“不变”).⑤根据本次实验测得的活性氧含量,可判断该实验产品所含的一种主要杂质为
尿素
尿素
. 如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸入2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题:
如图1和2是某校实验探究小组制备NH3 并进行性质实验时的改进装置.按图1把仪器安装好,称取2g 固体氯化铵装入试管底部,再快速称取2g 氢氧化锅覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2mL浓氨水);烧杯内盛滴有酚酞试液的水.把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.将上述装置中收满NH3的圆底烧瓶取下,改装成图2所示的装置,胶头滴管内事先吸入2mLH2O,此时小气球系在玻璃管上呈自然松驰状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质.按要求回答下列问题:(1)教材中是用与制O2相同的制备装置来加热制取NH3的,该反应的化学方程式为:
2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2
| ||
2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2
.
| ||
(2)下面是部分同学对于能用图1制取NH3的原因分析,有道理的是
①②③④
①②③④
.①在NH3?H2O中有平衡 NH3+H2O=NH3?H2O=NH4++OH-,NaOH使平衡向左移动; ②在NH3?H2O中有平衡阳NH3+H2O=NH3?H2O=NH4++OH-,NH4Cl 使平衡向左移动; ③NaOH 溶于水时放热,使体系的温度升高,NH3的溶解度减小;④NH4Cl与NaOH在此情况下可反应生成NH3,即NH4++OH-
| ||
(3)判断图1中烧瓶己收满NH3的现象
烧杯内的溶液变红
烧杯内的溶液变红
.(4)图2中胶头漓管中的水挤入烧瓶后,观察到的现象是
气球逐渐变大
气球逐渐变大
它说明了NH3极易溶于水
极易溶于水
.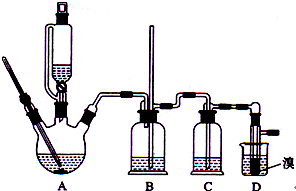 (2012?海南)实验室制备1,2-二溴乙烷的反应原理如下:
(2012?海南)实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH→CH2=CH2
CH2=CH2+B2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是
d
d
;(填正确选项前的字母)a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入
c
c
,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是
溴的颜色完全褪去
溴的颜色完全褪去
;(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在
下
下
层(填“上”、“下”);(5)若产物中有少量未反应的Br2,最好用
b
b
洗涤除去;(填正确选项前的字母)a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用
蒸馏
蒸馏
的方法除去;(7)反应过程中应用冷水冷却装置D,其主要目的是
乙烯与溴反应时放热,冷却可避免溴的大量挥发,
乙烯与溴反应时放热,冷却可避免溴的大量挥发,
;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞
1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞
.