网址:http://m.1010jiajiao.com/timu3_id_374259[举报]
⑴当n=2时,AB2属于_______分子(填“极性”或“非极性”),分子中有_______个π键。A6H6分子中A原子的杂化轨道类型是_______杂化。
⑵当n=3时,A与B形成的晶体属于_______晶体。
⑶若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_______(用元素符号表示)。
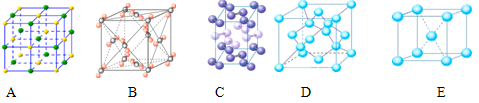
Ⅱ.⑴下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__________(请用相应的编号填写)
⑶已知某红紫色配合物的组成为CoCl3·5NH3·H2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为___________。
⑷下图是金属铝晶体结构的示意图。已知金属铝的密度为2.7g/cm3,则紧邻的铝原子的半径为_____________cm。(已知
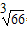 =4.04)
=4.04) 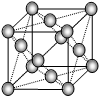
V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20。其中:X、Z是金属元素;V和Z元素原子的最外层都只有一个电子,且V为非金属元素;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此推知:
(1)V是 , X是 , Z是 (填元素符号)。
(2)Y在元素周期表中的位置是 。
(3)写出Z离子的结构示意图 。
(4)W、Y两种元素和氢组成的气态氢化物(填化学式)中稳定性最好的是 ,还原性最强的是 。
(5)五种元素的原子半径由大到小的顺序为(用元素符号表示) 。
(6)X和Z的金属性由强到弱的顺序为 (用元素符号表示),可以说明此强弱关系的事实是(任写一例即可) 。
查看习题详情和答案>>Ⅰ.A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子。请回答下列问题:
⑴当n=2时,AB2属于_______分子(填“极性”或“非极性”),分子中有_______个π键。A6H6分子中A原子的杂化轨道类型是_______杂化。
⑵当n=3时,A与B形成的晶体属于_______晶体。
⑶若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是_______(用元素符号表示)。
Ⅱ.⑴下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__________(请用相应的编号填写)

⑶已知某红紫色配合物的组成为CoCl3·5NH3·H2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为___________。
⑷下图是金属铝晶体结构的示意图。已知金属铝的密度为2.7g/cm3,则紧邻的铝原子的半径为_____________cm。(已知
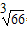 =4.04)
=4.04) 
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
请回答下列问题:
(1)B、C、D三种元素的电负性由大到小的顺序是 (填元素符号)。
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的分子式为 。(写出2种即)
(3)与C同族、且位于第四周期元素所形成气态化物的电子式为 ,它属于 (填“极性”或“非极性”)分子,其沸点低于C的氢化物的沸点,主要原因是 。
(4)F的基态原子核外电子排布式是 。
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能 (填“大”或“小”)。
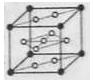
(6)氢气是理想的清洁能源,X元素与镧(La)元素的合金可做储氢材料,该合金的晶胞如右图所示,晶胞中心有一个X原子,其他X原子都在晶胞面上,则该晶体的化学式为 。已知该晶体的密度为![]() ,其摩尔质量为
,其摩尔质量为![]() ,则该晶胞的体积是 。(请列出算式)
,则该晶胞的体积是 。(请列出算式)
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
请回答下列问题:
(1)B、C、D三种元素的电负性由大到小的顺序是 (填元素符号)。
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的分子式为 。(写出2种即)
(3)与C同族、且位于第四周期元素所形成气态化物的电子式为 ,它属于 (填“极性”或“非极性”)分子,其沸点低于C的氢化物的沸点,主要原因是 。
(4)F的基态原子核外电子排布式是 。
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能 (填“大”或“小”)。
(6)氢气是理想的清洁能源,X元素与镧(La)元素的合金可做储氢材料,该合金的晶胞如右图所示,晶胞中心有一个X原子,其他X原子都在晶胞面上,则该晶体的化学式为 。已知该晶体的密度为![]() ,其摩尔质量为
,其摩尔质量为![]() ,则该晶胞的体积是 。(请列出算式)
,则该晶胞的体积是 。(请列出算式)
查看习题详情和答案>>