网址:http://m.1010jiajiao.com/timu3_id_37404[举报]
分类作为一种重要的化学思想,在科学研究中占有重要的地位.氧化还原反应有多种分类方法,其中根据参与电子转移的元素种类不同的分类方法最常见.下列所提供的反应中电子转移发生在相同价态的同种元素之间的有________(填序号,下同);电子转移发生在不同价态的同种元素之间的有________;电子转移发生在不同元素之间的有________.
①C+CO2=2CO ②NH4NO3=N2O↑+2H2O ③2KClO3=2KCl+3O2↑
④S+2KNO3+3C=K2S+N2↑+3CO2↑ ⑤3Cl2+6NaOH=5NaCl+NaClO3+3H2O
⑥HgS+O2=Hg+SO2(说明:均未注反应条件)
查看习题详情和答案>>
![]() ① □MnO4―+□H2O2+□H+
□Mn2++□O2十□H2O
① □MnO4―+□H2O2+□H+
□Mn2++□O2十□H2O
![]() ② H2O2+2
② H2O2+2![]() +2H+
I2+2H2O
+2H+
I2+2H2O
O
‖
![]() ③ CH3C—O—OH+2
③ CH3C—O—OH+2![]() +2H+ CH3COOH+I2+H2O
+2H+ CH3COOH+I2+H2O
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
![]() □MnO4―+□H2O2+□H+
□Mn2++□O2十□H2O
□MnO4―+□H2O2+□H+
□Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·![]() 的KmnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
的KmnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·![]() 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ________________________。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
查看习题详情和答案>>
实验室用N2、H2合成氨气,并用酚酞试液检验生成的NH3.用锌与盐酸反应制取H2;用NaNO2饱和溶液和NH4Cl饱和溶液共热制取N2:
NaNO2+NH4Cl=NaCl+NH4NO2
NH4NO2![]() N2↑+2H2O
N2↑+2H2O
制备装置如下图所示:
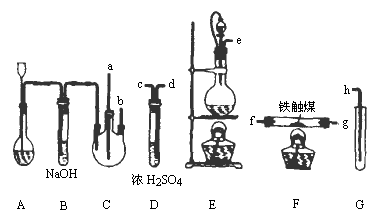
(1)装置A用于制取________.
(2)装置E中分液漏斗上方常用导管与圆底烧瓶内相通,作用是________.装置E与装置C直接相连,连接时导管口连接方法为e接________.
(3)装置C的另一接口与其他仪器装置相连接时,导管口的连接顺序为:另一接口________接________,________接________,________接________.
(4)装置D的作用为________.装置F导出的气体成分为________.
(5)装置G内盛滴有酚酞的试液,用于检验NH3的生成.该装置中导管口能否插入液面以下________(填“能”或“不能”),理由是________.
(6)从充分利用原料的角度看,装置G应装双孔塞,此时另一接口应怎样处理为佳?答:________.
查看习题详情和答案>>