网址:http://m.1010jiajiao.com/timu3_id_374033[举报]
(1)下列选项与NOx对环境的污染无关的是
A.酸雨 B.赤潮 C.光化学烟雾 D.温室效应
(2)在汽车尾气排放管中安装一个催化转化器,可将尾气中另一种有害气体CO跟NO反应转化为无毒气体,该反应的化学方程式为
(3)氨气也可以用于处理氮氧化物,例如,氨气与二氧化氮发生如下反应:6NO2+8NH3=7N2+12H2O,标出反应的电子转移的数目和方向

苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代.工业上利用上述信息,按下列路线合成结构简式为
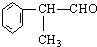 的物质,该物质是一种香料.
的物质,该物质是一种香料.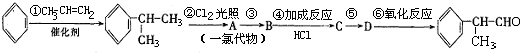
请根据上述路线,回答下列问题:
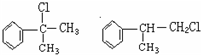
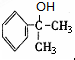
(1)A的结构简式可能为

(2)反应①、③、⑤的反应类型分别为
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
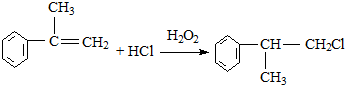
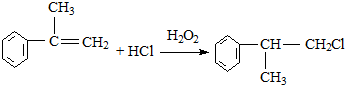
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是
 生成,
生成, 生成,
生成,(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种.写出符合上述条件的物质可能的结构简式(只写两种):


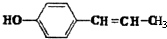

(17分).有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(一) 苯的同系物与卤素单质混合,在光照条件下,侧链上的氢原子被卤素原子取代;
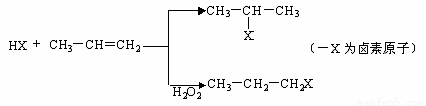
(二)工业上利用上述信息,按下列路线合成结构简式为的物质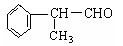 ,该物质是氢化阿托醛一种香料。
,该物质是氢化阿托醛一种香料。
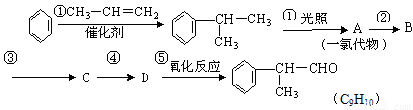
请根据上述路线,回答下列问题:
(1)A为一氯代物,它的结构简式可能为_______________________________________。
(2)工业生产过程中,中间产物必须经过②③④得到D,而不采取直接转化为D的方法原因是_____________________________________。
(3)写出反应类型 ②_________、③_________。
(4)反应④的化学方程式为:__________________________________________。
(5)氢化阿托醛与氢气1:1加成后的产物C9H10O的同分异构体很多,写出两种符合下列三个条件的 C9H10O的同分异构体的结构简式:__________________、___________________。
①能与溴水反应
②能与氢氧化钠溶液反应
③分子中只有苯环一种环状结构,苯环上有两个取代基,且苯环上的一溴代物有两种;
(6)氢化阿托醛发生银镜反应的化学方程式为_____________________________________。
查看习题详情和答案>>
(17分).有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(一) 苯的同系物与卤素单质混合,在光照条件下,侧链上的氢原子被卤素原子取代;
(二)工业上利用上述信息,按下列路线合成结构简式为的物质,该物质是氢化阿托醛一种香料。
请根据上述路线,回答下列问题:
(1)A为一氯代物,它的结构简式可能为_______________________________________。
(2)工业生产过程中,中间产物必须经过②③④得到D,而不采取直接转化为D的方法原因是_____________________________________。
(3)写出反应类型 ②_________、③_________。
(4)反应④的化学方程式为:__________________________________________。
(5)氢化阿托醛与氢气1:1加成后的产物C9H10O的同分异构体很多,写出两种符合下列三个条件的 C9H10O的同分异构体的结构简式:__________________、___________________。
①能与溴水反应
②能与氢氧化钠溶液反应
③分子中只有苯环一种环状结构,苯环上有两个取代基,且苯环上的一溴代物有两种;
(6)氢化阿托醛发生银镜反应的化学方程式为_____________________________________。
查看习题详情和答案>>
(14分)HNO3是极其重要的化工原料。工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的。(1)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失)。
① 试写出上述反应的化学方程式。
② 设循环操作的次数为n,试写出NO2→HNO3转化率与循环操作的次数n之间关系的数学表达式。
③ 计算一定量的二氧化氮气体要经过多少次循环操作,才能使95%的二氧化氮转变为硝酸?
(2) 上述方法制备的HNO3为稀硝酸,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3。实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相产物有Mg(NO3)2,NH4NO3和H2O。生成这些产物的HNO3浓度范围为:H2:c<6.6 mol/L;N2和NH4+:c<10 mol/L;NO:0.1 mol/L<c<10 mol/L;NO2:c>0.1 mol/L。各气相产物成分及含量随HNO3浓度变化曲线如下图所示。
④ 写出Mg与11 mol/L的HNO3反应的方程式;
⑤ 960 mg Mg与一定体积4 mol/L的HNO3恰好完全反应,收集到224 mL气体(S.T.P)气体,试通过计算写出反应方程式。
查看习题详情和答案>>