网址:http://m.1010jiajiao.com/timu3_id_373913[举报]
 金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重.
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重.(1)钢铁在中性溶液中腐蚀时,正极的电极反应式为
(2)钢铁的钝化处理是达到钢铁防腐目的方法之一.经冷的浓HNO3处理后,其表面有一层致密氧化膜.但在加热或稀HNO3中就不能“钝化”,不同浓度的HNO3与铁反应还原产物复杂,其分布曲线如图所示.
①由图示可知,密度为1.05g?L-1的HNO3与铁反应还原产物主要是
②由图示分析可知,HNO3与铁反应时随着硝酸密度的增大生成主要还原产物的规律是
③若mgFe与含ngHNO3的硝酸溶液恰好完全反应,HNO3的还原产物只有NO,则m的取值范围是
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是
A.在铁中掺入铬、镍等金属,改变其内部结构,制成不锈钢
B.在铁制品表面镀锌
C.将水库铁闸门与直流电源的负极相连
D.提高铁中含碳量,制成生铁. 查看习题详情和答案>>
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe 2+.实验步骤如下:

(1)实验室用18.4mol?L-1的浓硫酸配制250mL4.8mol?L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种带有刻度的移液管)外,还需______.
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是______.
A.控制溶液中Fe2+与Fe3+含量比 B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用NaClO3氧化时的离子方程式______(提示:ClO3-转化为Cl-);
已知1mol HNO3的价格为0.16元,1mol NaClO3的价格为0.45元,评价用HNO3代替NaClO3作为氧化剂的利弊,利是______,弊是______.
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+物质的量之比,有人设计了以下操作:
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m g.
(b)另取25mL聚合硫酸铁溶液,加足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO4酸性溶液滴定,到达终点时用去0.1000mol/L KMnO4标准溶液VmL.反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
回答下列问题:
①判断(a)步骤溶液中SO42-离子已沉淀完全的方法是______;
②在(b)步骤中判断达到终点的现象是______;
③聚合硫酸铁中SO42-与Fe3+的物质的量之比为______(用含m、V的代数式表示).
查看习题详情和答案>>
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大。
⑴钢铁的表面发蓝、发黑处理是常用的防腐方法。下列反应是主要反应之一。
请配平化学方程式:
口Na2FeO2+ 口NaNO2+ 口 =口 NaFeO2+ 口NH3↑+ 口NaOH
⑵钢铁的“钝化”处理也能达到防腐目的,经冷、浓HNO3处理后,其表面有一层致密氧化物保护膜,但是加热或在稀HNO3中就不能“钝化”。不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图。

①图示可知,密度大于1.35 g?mL-1的硝酸与铁反应时,其还原产物主要是 ;密度为1.05g?mL-1 的硝酸与铁反应时,其最多的还原产物是 ;分析HNO3与铁反应的规律是 。
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是: 。
⑶金属 (M) 的腐蚀是因为发生反应: M-ne-→Mn+。钢铁除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)。
A.在铁中掺入铬、镍等金属,改变其内部结构,制成不锈钢
B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
查看习题详情和答案>>金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大。
(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。下列反应是主要反应之一。
请配平方程式:口 Na2FeO2+ 口 NaNO2+ 口 = 口 NaFeO2+ 口 NH3↑+ 口 NaOH
(2)钢铁的“钝化”处理也能达到防腐目的,经冷、浓 HNO3 处理后,其表面有一层致密氧化物保护膜,但是加热或在稀HNO3中 就不能 “钝化”。不同浓度的HNO3 与铁反应的还原产物很复杂,其分布曲线如图。
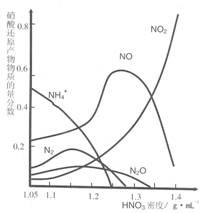
①图示可知,密度为 1.05g?mL-1 的硝酸与铁反应时,其最多的还原产物是
;密度大于1.35 g?mL-1的硝酸与铁反应时,其还原产物主要是 NO2;分析HNO3 与铁反应的规律是: 。
② mg 铁与含 n g HNO3的硝酸溶液恰好完全反应,若硝酸的还原产物只有 NO, 则 m 的取值可能是 (填字母编号 )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]() E.
E.![]()
③工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是:
。
(3)金属 (M) 的腐蚀是因为发生反应: M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铭、镇等金属,改变其内部结构,制成不锈钢
B.在铁制品表面镀辞
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
查看习题详情和答案>>(12 分 )金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大。
(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。下列反应是主要反应之一。
请配平方程式:口Na2FeO2+ 口 NaNO2+ 口 = 口 NaFeO2+ 口 NH3↑+ 口 NaOH
 (2)钢铁的“钝化”处理也能达到防腐目的,经
(2)钢铁的“钝化”处理也能达到防腐目的,经
冷、浓 HNO3处理后,其表面有一层致密氧化物保
护膜,但是加热或在稀HNO3中 就不能 “钝化”。
不同浓度的 HNO3与铁反应的还原产物很复杂,
其分布曲线如图。
① 图示可知,密度为 1.05g·mL-1 的硝酸与铁
反应时,其最多的还原产物是 ;密度大于1.35 g·mL-1的硝酸与铁反应时,其还原产物主要是 NO2;分析HNO3 与铁反应的规律是:
。
② mg 铁与含 n g HNO3的硝酸溶液恰好完全反应,若硝酸的还原产物只有NO, 则 m 的取值可能是 (填字母编号 )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]() E.
E.![]()
③工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是: 。
(3)金属 (M) 的腐蚀是因为发生反应: M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铭、镇等金属,改变其内部结构,制成不锈钢
B.在铁制品表面镀辞
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
查看习题详情和答案>>