摘要:26.将2株大小一样.发育相同的健壮薄荷苗A.B.分别在加土的雨水和雨水中培养.经过一段时间.A.B两株植物在长势和重量上的差别很大.结果如下表.请回答: 植株 培养液 植株的重量(g) 重量增加量(g) 实验前 实验后 A 加土雨水 92 378 268 B 雨水 91 1455 54 (1)植株重量增加的重要原因之一是由于植株进行 作用.合成了有机物,其原料除了水.还需要吸收大气中的 (2)植株A.B吸收的水分除了一小部分用于自身的生命活动外.大部分通过 作用散失到空气中.因此.植树造林可以增加空气湿度.调节气候. (3)植株A与B的差别说明植物的生长除了需要吸收水分外.还需要从培养液中吸收 .这是一个主动运输的过程,需要消耗 .陆地栽培植物.在土壤淹水时.根部细胞会进行 .产生 等物质.造成对根细胞的伤害. 27.下图表示人体内三大营养物质代谢之间的关系.据图回答: (1)从图中看出糖类.脂质和蛋白质之间可以转化. 氨基酸必须通过 作用才能转化成糖类和脂肪. (2)人体中主要的能源物质是 .人在饥饿初期. 血糖含量会暂时降低.这时 可以分解成葡 萄糖并进入血液.使血糖含量恢复正常. (3)某人多食少动.导致肥胖.其原因除了由于多食的脂肪储存在体内外. 还可能发生了图中的 过程,为了减肥.他只吃水果.蔬菜和 米饭.一段时间后.不仅体重未减轻.而且造成营养不良.其体内缺少的营 养物质主要是 (4)血红蛋白是由574个氨基酸经过图中⑦过程形成的一种具有四条肽链的蛋白质.在这些氨基酸形成 1个血红蛋白分子的过程中.共脱去 个水分子.
网址:http://m.1010jiajiao.com/timu3_id_37382[举报]
某同学在学习化学反应速率时做了两个实验:
实验一是用纯度、质量、表面积都相同的两铝片与氢离子浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快.
实验二是用相同浓度的稀盐酸与两块铝片(一片是纯铝,另一是含有杂质的铝,含的杂质以铜为主)发生反应时,发现盐酸与含杂质的铝反应产生氢气的速率比纯铝反应更快.他决定对其原因进行探究.请填写下列空白:
对于实验一:
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:
原因Ⅲ:Cl-对反应具有促进作用,而SO2-4对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-都对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:
(2)该同学设计进行了两组实验,即得出了正确的结论.他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有体积相同、H+浓度相同的稀硫酸和盐酸的试管(两试管的规格相同)中;
①在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化.
②在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化.
③若观察到实验①中
对于实验二:该同学通过查阅资料知道是因为含杂质的铝与盐酸反应时形成了微小的原电池,使铝片与盐酸反应生成氢气的速率加快.为了验证资料中所说的事实,请帮助该同学设计一个对比实验来验证这一事实.
查看习题详情和答案>>
实验一是用纯度、质量、表面积都相同的两铝片与氢离子浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快.
实验二是用相同浓度的稀盐酸与两块铝片(一片是纯铝,另一是含有杂质的铝,含的杂质以铜为主)发生反应时,发现盐酸与含杂质的铝反应产生氢气的速率比纯铝反应更快.他决定对其原因进行探究.请填写下列空白:
对于实验一:
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:
Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
;原因Ⅲ:Cl-对反应具有促进作用,而SO2-4对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-都对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:
Cl-、SO42-都对反应具有阻碍作用,但Cl-影响更小;
Cl-、SO42-都对反应具有阻碍作用,但Cl-影响更小;
.(2)该同学设计进行了两组实验,即得出了正确的结论.他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有体积相同、H+浓度相同的稀硫酸和盐酸的试管(两试管的规格相同)中;
①在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化.
②在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化.
③若观察到实验①中
反应速率加快、
反应速率加快、
,实验②中反应速率减慢
反应速率减慢
,则说明原因Ⅲ是正确的.依此类推.该同学通过分析实验现象,得出了结论:Cl-对反应具有促进作用.对于实验二:该同学通过查阅资料知道是因为含杂质的铝与盐酸反应时形成了微小的原电池,使铝片与盐酸反应生成氢气的速率加快.为了验证资料中所说的事实,请帮助该同学设计一个对比实验来验证这一事实.
取两片相同的纯铝片和相同浓度、体积的稀盐酸.将一片铝直接放入稀盐酸中,另一片铝和一片铜接触后再放入稀盐酸中,对比它们产生氢气的速率的大小
取两片相同的纯铝片和相同浓度、体积的稀盐酸.将一片铝直接放入稀盐酸中,另一片铝和一片铜接触后再放入稀盐酸中,对比它们产生氢气的速率的大小
.下表为元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意简图为
 ;
;
(2)表中能形成两性氢氧化物的元素是
(3)①、②、⑦、⑧四种元素的最高价氧化物对应水化物中酸性最强的是
(4)③元素和(11)元素两者的核电荷数之差是
(5)④、⑤两元素相比较,金属性较强的是
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C.将形状、大小相同的这两种元素的单质分别和热水作用,并滴入酚酞溶液
D.比较这两种元素气态氢化物的稳定性
(6)高性能的现代通讯材料--光导纤维是
(7)③与⑩能形成
(8)⑩的单质与水反应的化学方程式
用洁净的铂丝棒蘸取上述反应后的溶液在酒精灯上灼烧,能够观察到
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ | (11) |


(2)表中能形成两性氢氧化物的元素是
Al
Al
(用元素符号表示),写出该氢氧化物与⑩的最高正价氧化物对应水化物反应的化学方程式Al(OH)3+KOH=KAlO2+2H2O
Al(OH)3+KOH=KAlO2+2H2O
;(3)①、②、⑦、⑧四种元素的最高价氧化物对应水化物中酸性最强的是
HClO4
HClO4
(用化学式表示);(4)③元素和(11)元素两者的核电荷数之差是
26
26
;(5)④、⑤两元素相比较,金属性较强的是
镁
镁
(填名称),可以验证该实验结论的实验是B C
B C
.A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C.将形状、大小相同的这两种元素的单质分别和热水作用,并滴入酚酞溶液
D.比较这两种元素气态氢化物的稳定性
(6)高性能的现代通讯材料--光导纤维是
⑥
⑥
(填编号)的氧化物制造出来的.写出该氧化物和氢氧化钠溶液反应的化学方程式SiO2+2NaOH═Na2SiO3+H2O
SiO2+2NaOH═Na2SiO3+H2O
.(7)③与⑩能形成
离子
离子
(填:“离子”或“共价”)化合物.(8)⑩的单质与水反应的化学方程式
2K+2H2O=2KOH+H2↑
2K+2H2O=2KOH+H2↑
.用洁净的铂丝棒蘸取上述反应后的溶液在酒精灯上灼烧,能够观察到
紫
紫
色火焰.下表为元素周期表的一部,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
(1)请写出②的元素符号
(2)请写出③的最高价氧化物的电子式
 .
.
(3)比较⑤、⑥、⑧的原子半径由大到小的顺序为(用元素符号表示)
(4)比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示)
(5)写出在元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式
(6)⑦⑧两元素相比较,金属性较强的是
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性.
查看习题详情和答案>>
| 族周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
Be
Be
(2)请写出③的最高价氧化物的电子式


(3)比较⑤、⑥、⑧的原子半径由大到小的顺序为(用元素符号表示)
Na>Al>F
Na>Al>F
(4)比较③、④、⑨的最高价含氧酸的酸性由强到弱的顺序是(用酸的化学式表示)
HNO3>H2CO3>H2SiO3(或H4SiO4)
HNO3>H2CO3>H2SiO3(或H4SiO4)
.(5)写出在元素①-⑩中最高价氧化物对应水化物的最强碱与最强含氧酸之间的化学反应方程式
NaOH+HClO4═NaClO4+H2O
NaOH+HClO4═NaClO4+H2O
(6)⑦⑧两元素相比较,金属性较强的是
镁
镁
(填名称),可以验证该结论的实验是(b)(c)
(b)(c)
(填编号).(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性.
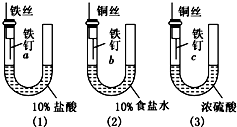 为了探究金属腐蚀的条件,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如下图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )
为了探究金属腐蚀的条件,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如下图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )| A、实验结束时,装置(1)左侧的液面一定会下降 | B、装置(2)中铁钉b发生电化学腐蚀 | C、实验结束时,装置(2)左边液面比右边高 | D、实验结束时,铁钉c腐蚀最严重 |
下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素为
(2)写出⑤的单质和⑨的最高价氧化物对应水化物反应的离子方程式
(3)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是
(4)④、⑤、⑦三种元素对应简单离子的半径由大到小的顺序
(5)可以验证④⑤两元素金属性较强的实验是
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
c.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性.
查看习题详情和答案>>
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | ||
| 2 | ① | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
Ar
Ar
(用元素符号表示);(2)写出⑤的单质和⑨的最高价氧化物对应水化物反应的离子方程式
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
;(3)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是
HClO4
HClO4
(填酸的化学式);(4)④、⑤、⑦三种元素对应简单离子的半径由大到小的顺序
Cl->Mg2+>Al3+
Cl->Mg2+>Al3+
(填离子的化学式);(5)可以验证④⑤两元素金属性较强的实验是
bc
bc
(填编号).a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
c.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性.