摘要:在实际生产中.反应2SO2 + O2 2SO3 ,△H<0 .应选择的适宜条件是( ) A.高温.高压.催化剂 B.低温.高压.催化剂 C.高温.低压.催化剂 D.适当温度.常压.催化剂
网址:http://m.1010jiajiao.com/timu3_id_373784[举报]
硫酸工业中2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0(放热反应)有关实验数据如下:
2SO3(g);ΔH<0(放热反应)有关实验数据如下:

(1)在生产中常用过量的空气是为了________.
(2)高温对该反应有何影响?________,实际生产中采用400~500℃的温度除了考虑速率因素外,还考虑到________.
(3)增大压强对上述反应有何影响?________,但工业上又常采用常压进行反应,其原因是________.
(4)常用浓H2SO4而不用水吸收SO3是由于________,尾气中SO2必须回收,主要是为了________.
下表是工业上除去燃煤烟气中二氧化硫的3种方法.
(1)方法1中,氨水吸收燃煤烟气中SO2的化学反应为:2NH3?H2O+SO2═(NH4)2SO3+H2O
下列措施一定能提高除去燃煤烟气中SO2速率的是 (填字母).
a.增大氨水浓度 b.升高反应温度 c.氨水以雾状与烟气混合接触
(2)方法2中,当含SO2的废气与O2被活性炭吸附时,发生反应:
2SO2(g)+O2(g)?2SO3(g)△H<O
为研究此反应,将SO2和O2放入容积固定的密闭容器中,一定条件下反应物浓度随时间变化如下表:
①反应2min内的平均反应速率v(SO3)= ;该条件下,此反应化学平衡常数K的值为 .
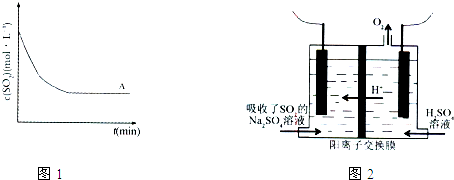
②上述条件(称为条件A)下,SO2的浓度随时间变化的曲线,如图1曲线所示.与条件A相比,条件B仅降低温度,条件C仅改用高效催化剂,请在图1中分别绘出条件B、条件C时,SO2浓度随时间变化的两条曲线.
(3)方法3中,用惰性电极电解的装置如图2.电解总反应为:H2SO3
O2↑+S↓+H2O
①该电解池阳极的电极反应式为 ,硫单质将在 得到(填“阴极”或“阳极”).
②若电解效率=实际产量/理论产量×100%,当电解吸收了池外电路通过2.00×10-2mol的电子时,收集到硫单质0.144g,则电解效率为 .
查看习题详情和答案>>
| 方法1 | 用氨水将SO2转化为(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法2 | 用活性炭吸附法处理SO2 |
| 方法3 | 用Na2SO4溶液吸收SO2,再进行电解得到S单质 |
下列措施一定能提高除去燃煤烟气中SO2速率的是
a.增大氨水浓度 b.升高反应温度 c.氨水以雾状与烟气混合接触
(2)方法2中,当含SO2的废气与O2被活性炭吸附时,发生反应:
2SO2(g)+O2(g)?2SO3(g)△H<O
为研究此反应,将SO2和O2放入容积固定的密闭容器中,一定条件下反应物浓度随时间变化如下表:
| t(min) 浓度(mol?L-1) |
0min | 1min | 2min | 3min | 4min | 5min | 6min |
| c(SO2) | 0.054 | 0.034 | 0.018 | 0.010 | 0.008 | 0.006 | 0.006 |
| c(O2) | 0.032 | 0.022 | 0.014 | 0.010 | 0.009 | 0.008 | 0.008 |
②上述条件(称为条件A)下,SO2的浓度随时间变化的曲线,如图1曲线所示.与条件A相比,条件B仅降低温度,条件C仅改用高效催化剂,请在图1中分别绘出条件B、条件C时,SO2浓度随时间变化的两条曲线.
(3)方法3中,用惰性电极电解的装置如图2.电解总反应为:H2SO3
| ||
①该电解池阳极的电极反应式为
②若电解效率=实际产量/理论产量×100%,当电解吸收了池外电路通过2.00×10-2mol的电子时,收集到硫单质0.144g,则电解效率为

硫酸工业中存在如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
(1)写出该反应的平衡常数表达式 ,升高温度平衡常数 (填“不变”、“增大”、“减小”).
(2)该反应达平衡后,若只增大压强,平衡将向 方向移动;若只升高温度,平衡向 方向移动.
(3)实际生产中要用过量的空气,原因是 ;还需加入催化剂,目的是 ;不在高温下进行该反应的理由是 .
查看习题详情和答案>>
(1)写出该反应的平衡常数表达式
(2)该反应达平衡后,若只增大压强,平衡将向
(3)实际生产中要用过量的空气,原因是
[化学--化学与技术]硫酸工业在国民经济中占有极其重要的地位.请回答硫酸工业中的如下问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在______的郊区(填标号);
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3 和SO2,该反应的化学方程式为______.
(3)为提高SO3吸收率,实际生产中通常用______吸收SO3.
(4)已知反应2SO2+O2?2SO3△H<0,现将0.050mol SO2和0.030mol O2充入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为______;该条件下的平衡常数为______.
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用______(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式______. 查看习题详情和答案>>
[化学--化学与技术]硫酸工业在国民经济中占有极其重要的地位.请回答硫酸工业中的如下问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3 和SO2,该反应的化学方程式为
(3)为提高SO3吸收率,实际生产中通常用
(4)已知反应2SO2+O2?2SO3△H<0,现将0.050mol SO2和0.030mol O2充入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
已知CuSO4 在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用
查看习题详情和答案>>
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在
C
C
的郊区(填标号);A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3 和SO2,该反应的化学方程式为
4CuFeS2+13O2
4CuO+2Fe2O3+8SO2
| ||
4CuFeS2+13O2
4CuO+2Fe2O3+8SO2
.
| ||
(3)为提高SO3吸收率,实际生产中通常用
98.3%的浓硫酸
98.3%的浓硫酸
吸收SO3.(4)已知反应2SO2+O2?2SO3△H<0,现将0.050mol SO2和0.030mol O2充入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为
80%
80%
;该条件下的平衡常数为1.6×103
1.6×103
.(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少
SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少
.(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用
石灰水
石灰水
(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式SO2+Ca(OH)2═CaSO3↓+H2O、CaSO3+H2SO4═CaSO4+SO2↑+H2O;
SO2+Ca(OH)2═CaSO3↓+H2O、CaSO3+H2SO4═CaSO4+SO2↑+H2O;
.