网址:http://m.1010jiajiao.com/timu3_id_373319[举报]
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
(2)某同学根据上述信息,所画的B电子排布图如图
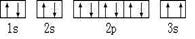 ,违背了 原理。
,违背了 原理。(3)F位于 族 区,其基态原子有 种运动状态。
(4)CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 ,检验E元素的方法是 。
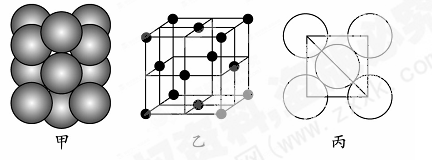
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。
(14分)(1)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g);△H>0,请回答下列问题:
P(g)+Q(g);△H>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)= 1 mol?L-1,c(N)=2.4 mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol?L-1,c(N)=amol?L-1;达到平衡后,c(P)=2 mol?L-1,a = mol?L-1。
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求。
①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
由上述方程式可知,CH3OH的燃烧热 (填“大于”、“等于”或“小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol,则氢气燃烧热的热化学方程式为 。
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。则c电极是 (填“正极”或“负极”),c电极上发生的电极反应是 。
 |
查看习题详情和答案>>
(本题共14分)
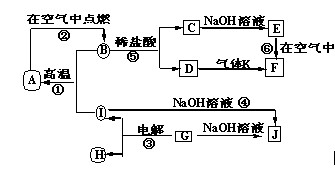
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
(1)A、B、C、D、E、F六种物质中的含有同一种元素在周期表中位置 ,
(2)写出检验D溶液中阳离子的方法 。
(3)写出反应④的离子方程式 。
(4)若28gA单质在足量的氧气中灼烧,反应放出的热量为QkJ(Q>0),写出这个反应的热化学方程式: ;
(5)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH 7
(填“>”、“<”或“=”),用离子方程式表示其原因: ;若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中含各离子物质的质量浓度由大到小的关系是 。
查看习题详情和答案>>
(本题共14分)
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
(1)A、B、C、D、E、F六种物质中的含有同一种元素在周期表中位置 ,
(2)写出检验D溶液中阳离子的方法 。
(3)写出反应④的离子方程式 。
(4)若28gA单质在足量的氧气中灼烧,反应放出的热量为QkJ(Q>0),写出这个反应的热化学方程式: ;
(5)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH 7
(填“>”、“<”或“=”),用离子方程式表示其原因: ;若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中含各离子物质的质量浓度由大到小的关系是 。
查看习题详情和答案>>
(本题共14分)
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
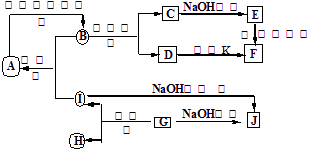
(1)A、B、C、D、E、F六种物质中的含有同一种元素在周期表中位置 ,
(2)写出检验D溶液中阳离子的方法 。
(3)写出反应④的离子方程式 。
(4)若28gA单质在足量的氧气中灼烧,反应放出的热量为QkJ(Q>0),写出这个反应的热化学方程式: ;
(5)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH 7
(填“>”、“<”或“=”),用离子方程式表示其原因: ;若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中含各离子物质的质量浓度由大到小的关系是 。
查看习题详情和答案>>