网址:http://m.1010jiajiao.com/timu3_id_373103[举报]
(A)【物质结构与性质】
有A、B、C、D、E、F六种元素,B原子得到一个电子后3p轨道全充满,A+比B原子形成的离子少一个电子层;C原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的;D和E是位于同一主族的短周期元素,E元素的最高化合价和最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%;F元素的核电荷数为26。
请回答下列问题:
(1)A元素位于元素周期表中第_________周期第_________族;F元素基态原子形成的+2价阳离子的电子排布式为_________。
(2)C与B形成的CB3分子中C原子的杂化方式是_______,其分子的空间形状是_______。
(3)另一元素X与A同主族,其第一电离能小于A,晶体XB与AB熔点较高的是_________,其理由是_______________________________________________________________。
(4)1 mol ED晶体中含有的E—D共价键的数目是_________。
(B)【实验化学】
阿司匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:

在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150 mL干燥锥形瓶中加入
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL 饱和碳酸氢钠溶液,加完后继续搅拌2—3 min,直到没有二氧化碳气体产生为止。过滤,用5—10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4 mol·L-1盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1—2次,再抽干水分,即得产品。
请回答下列问题:
(1)第①步中,要控制温度在85—
(2)在第②步中,用冷水洗涤晶体,其目的是_________________________________________、__________________________________________。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是___________________________________,加入盐酸的作用是________________________________________。
(4)如何检验产品中是否混有水杨酸?___________________________________________
____________________________________________________________________。
查看习题详情和答案>>实验室需要2.0 mol·L-1NaOH溶液90mL,请回答下列问题:
(1)配制过程中不需要使用到的化学仪器有 (填字母)
A.烧杯 B. 100mL容量瓶 C. 漏斗 D.胶头滴管 E.玻璃棒
(2)用托盘天平称取氢氧化钠,其质量为 g;
(3)下列主要操作步骤的正确顺序是 (填序号);
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1—2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到100mL容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中;
(4)在实验中其他操作均正确,如实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度 (填“偏高”或“偏低”或“不变”);若定容时仰视刻度线,则所得溶液浓度 2.0 mol·L-1(填“大于”或“小于”或“等于”)。
查看习题详情和答案>>
化学是一门以实验为基础的学科,熟练使用中学化学实验中的常见仪器,熟悉常见实验用品是正确进行实验的基础.试回答以下问题:
(1)现有如下仪器,用序号回答有关问题:
①容量瓶
②蒸馏烧瓶
③滴定管
④量筒
⑤烧杯
⑥蒸发皿
⑦分液漏斗
对允许加热的仪器,加热时必须垫石棉网的有________;
使用时必须检查是否漏水的有________;标有“0”刻度的有________.
(2)拟在烧杯中在加热条件下配制50 mL某溶液,应选择的烧杯是________(用字母回答).
a.400 mL烧杯
b.250 mL烧杯
c.100 mL烧杯
d.50 mL烧杯
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体.可供选择的液体试剂有:浓硫酸、稀硫酸、浓盐酸、稀盐酸、浓氨水,丙中试剂为紫色石蕊溶液.请回答下列问题:

①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶?A中?的试剂与分液漏斗B中的试剂均为无色液体,则烧瓶A中的试剂为________,制取该气体利用了分液漏斗B中试剂的性质有________、________.
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满.若石蕊溶液变蓝,则烧瓶A中应加入的固体试剂为________.
②若在乙中收集氨气,气体流经装置的顺序是:a→________→________→d(填接口代号).
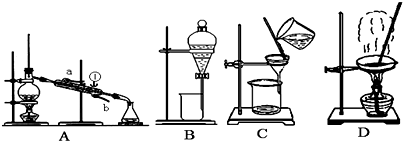
(1)从氯化钾溶液中得到氯化钾固体,选择装置______(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置______.
(2)从碘水中分离出I2,选择装置______,该分离方法的名称为______.
(3)装置A中①的名称是______,进出水的方向是______.
(4)装置B在分液时为使液体顺利下滴,应进行的具体操作是______.(填代表选项的字母)
A.应该先将分液漏斗上的活塞拿下后再打开旋塞放出液体
B.加热
C.使分液漏斗上的活塞上的凹槽对准分液漏斗上的小孔后再打开旋塞放出液体.
Ⅱ.某同学按下列步骤配制250mL 0.2mol?L-1NaCl溶液,请回答有关问题.
| 实验步骤 | 有关问题 |
| ①计算所需NaCl的质量 | |
| ②称量NaCl固体 | 用托盘天平需要称量NaCl的质量为______g. |
| ③将NaCl加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施:______. |
| ④将烧杯中溶液转移至250mL容量瓶中 | 为了防止溶液溅出,应采取什么措施:______. |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2厘米处应如何操作: ______. |
(2)取出该NaCl溶液10mL加水稀释到100mL,稀释后溶液中Na+的物质的量浓度是______.
(3)若进行⑤步操作时加蒸馏水超过刻度线,则需______.
(4)配制NaCl溶液时,下列操作情况会使结果偏高的是______.
A.移液前,容量瓶中有少量蒸馏水
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容.
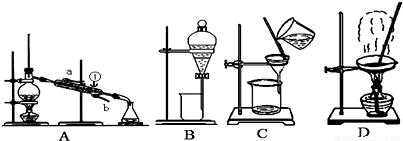
(1)从氯化钾溶液中得到氯化钾固体,选择装置______(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置______.
(2)从碘水中分离出I2,选择装置______,该分离方法的名称为______.
(3)装置A中①的名称是______,进出水的方向是______.
(4)装置B在分液时为使液体顺利下滴,应进行的具体操作是______.(填代表选项的字母)
A.应该先将分液漏斗上的活塞拿下后再打开旋塞放出液体
B.加热
C.使分液漏斗上的活塞上的凹槽对准分液漏斗上的小孔后再打开旋塞放出液体.
Ⅱ.某同学按下列步骤配制250mL 0.2mol?L-1NaCl溶液,请回答有关问题.
| 实验步骤 | 有关问题 |
| ①计算所需NaCl的质量 | |
| ②称量NaCl固体 | 用托盘天平需要称量NaCl的质量为______g. |
| ③将NaCl加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施:______. |
| ④将烧杯中溶液转移至250mL容量瓶中 | 为了防止溶液溅出,应采取什么措施:______. |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2厘米处应如何操作: ______. |
(2)取出该NaCl溶液10mL加水稀释到100mL,稀释后溶液中Na+的物质的量浓度是______.
(3)若进行⑤步操作时加蒸馏水超过刻度线,则需______.
(4)配制NaCl溶液时,下列操作情况会使结果偏高的是______.
A.移液前,容量瓶中有少量蒸馏水
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容.
查看习题详情和答案>>