网址:http://m.1010jiajiao.com/timu3_id_372860[举报]
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用![]() 与水反应生成乙炔。
与水反应生成乙炔。
(1) 中
中 与
与 互为等电子体,
互为等电子体, 的电子式可表示为____;1mol
的电子式可表示为____;1mol ![]() 中含有的
中含有的![]() 键数目为_____。
键数目为_____。
(2)将乙炔通入![]() 溶液生成
溶液生成 ,红棕色沉淀。
,红棕色沉淀。 基态核外电子排布式为_____。
基态核外电子排布式为_____。
 (3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是_____;分子中处于同一直线上的原子数目最多为_____。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是_____;分子中处于同一直线上的原子数目最多为_____。
(4) 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如右图所示),
晶体的相似(如右图所示),
但![]() 晶体中含有的中哑铃形
晶体中含有的中哑铃形![]() 的存在,使晶胞沿一个
的存在,使晶胞沿一个
方向拉长。![]() 晶体中1个
晶体中1个![]() 周围距离最近的
周围距离最近的![]() 数
数
目为_____。
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在溶剂中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是 ___。
(2)滤液在分液漏斗中洗涤静置后,有机层处于___ 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 ___。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是______。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_______、______。
查看习题详情和答案>>
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
(1) 中
中 与
与 互为等电子体,
互为等电子体, 的电子式可表示为____;1mol
的电子式可表示为____;1mol  中含有的
中含有的 键数目为_____。
键数目为_____。
(2)将乙炔通入 溶液生成
溶液生成 ,红棕色沉淀。
,红棕色沉淀。 基态核外电子排布式为_____。
基态核外电子排布式为_____。
 (3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是_____;分子中处于同一直线上的原子数目最多为_____。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是_____;分子中处于同一直线上的原子数目最多为_____。
(4) 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如右图所示),
晶体的相似(如右图所示),
但 晶体中含有的中哑铃形
晶体中含有的中哑铃形 的存在,使晶胞沿一个
的存在,使晶胞沿一个
方向拉长。 晶体中1个
晶体中1个 周围距离最近的
周围距离最近的 数
数
目为_____。
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在溶剂中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是 ___。
(2)滤液在分液漏斗中洗涤静置后,有机层处于___ 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 ___。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
|
催化剂 |
n(催化剂) |
硝化产物中各种异构体质量分数(%) |
总产率(%) |
||
|
n(甲苯) |
对硝基甲苯 |
邻硝基甲苯 |
间硝基甲苯 |
||
|
浓H2SO4 |
1.0 |
35.6 |
60.2 |
4.2 |
98.0 |
|
1.2 |
36.5 |
59.5 |
4.0 |
99.8 |
|
|
NaHSO4 |
0.15 |
44.6 |
55.1 |
0.3 |
98.9 |
|
0.25 |
46.3 |
52.8 |
0.9 |
99.9 |
|
|
0.32 |
47.9 |
51.8 |
0.3 |
99.9 |
|
|
0.36 |
45.2 |
54.2 |
0.6 |
99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是______。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_______、______。
查看习题详情和答案>>
A.雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.
(1)元素第一电离能:Al
(2)雷尼镍催化的一实例为:
 化合物b中进行sp
化合物b中进行sp 3杂化的原子有:
3杂化的原子有:(3)一种铝镍合金的结构如下图,与其结构相似的化合物是:
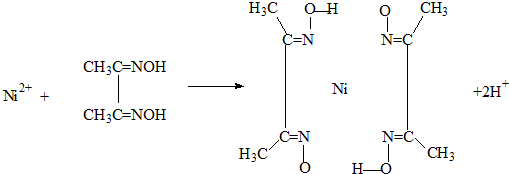
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
①Ni2+在基态时,核外电子排布式为:
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为
B.4-氯苯胺是合成橡胶、化学试剂、染料、色素等化工产品,制备4-氯苯胺的原理如下:
 .在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂,
.在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂, )、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
)、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.(1)开始时先通入N2的目的是
(2)上述实验中过滤的目的是
(3)蒸馏时除用到接引管、锥形瓶、温度计外,还用到的玻璃仪器有:
(4)以下是温度、氢气压力、催化剂用量及吗啉的用量对反应的影响.
| 表1温度 | 表2氢气压力 | 表3催化剂用量 | 表4吗啉用量 | |||||||||||||||
| 序号 | 温度/℃ | 转化率/% | 选择 性/% |
反应时间/h | 序号 | 氢气压力/MPa | 选择性/% | 反应时间/h | 序号 | 雷尼镍用量/g | 选择性/% | 反应时间/h | 序号 | 吗啉用量/% | 选择性/% | |||
| ① | 40 | 未完全 | 99.6 | 6 | ① | 0.5 | 99.6 | 3.7 | ① | 2 | 98.25 | 5 | ① | 0.0 | 84.3 | |||
| ② | 60 | 100 | 99.7 | 4 | ② | 1.0 | 99.7 | 2 | ② | 4 | 99.20 | 2.2 | ② | 0.3 | 99.3 | |||
| ③ | 80 | 100 | 99.6 | 2.45 | ③ | 1.5 | 99.2 | 1.6 | ③ | 6 | 99.60 | 1.9 | ③ | 0.5 | 99.7 | |||
| ④ | 100 | 100 | 99.6 | 2 | ④ | 2.0 | 96.4 | 1.15 | ④ | 8 | 99.60 | 1.4 | ④ | 0.7 | 99.6 | |||
| ⑤ | 120 | 100 | 98.6 | 1.7 | ⑤ | ⑤ | 10 | 99.10 | 1.4 | ⑤ | 1.2 | 99.7 | ||||||
| 成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
(2)电渗析法淡化海水示意图如图1所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如图2所示:

①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2?6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4mol/L.
①饱和Mg(OH)2溶液中滴加酚酞,现象是
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量
| C | Si | Mn | P | S |
| 4.070% | 2.900% | 0.495% | 0.165% | 0.010% |
(2)磷肥的肥效以相当含P2O5多少来表示.炼钢时,P元素形成炉渣Ca3(PO4)2,后者再与浓硫酸反应制得普通过磷酸钙[即普钙,成分是CaSO4、Ca(H2PO4)2和少量其它杂质].若某普钙中Ca(H2PO4)2的质量分数为45.25%,则含P2O5的质量分数为
(3)锰的质量分数为30%的高锰钢有很好的性能,可制作火车车轮.将A冶炼成含碳0.4%、含锰30%的高锰钢(设铁无损耗,其它杂质已除去,可补充锰),则100吨A可制得高锰钢
(4)某炼钢厂的烟尘成分和质量分数如下表:
| FeO | Fe2O3 | CaO | |
| 烟尘煅烧前(%) | 86.40 | 4.00 | 9.60 |