摘要:28.校办厂漂白车间需22.4 LSO2.化学小组同学依据化学方程式Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O计算后.取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g/cm3)110mL充分反应.锌全部溶解后.即将收集所得气体如数送至车间.不料经质检科检验存在严重质量问题.气体随即被退回. (1)化学小组所制得的气体中混有的主要杂质气体可能是 .产生这种结果的主要原因是 . (2)为证实相关分析.化学小组的同学设计了如下实验.对退回气体(X)取样进行认真探究(遇有气体吸收过程.视为全吸收). ①组装好仪器后.盛放药品前.必要的一个操作是 . ②A中加入的试剂可能是: .作用是: . B中加入的试剂可能是: .作用是: . ③可证实气体x中混有较多量某杂质气体的实验现象是: C中: .D中: . (3)对上述装置略加改进.可粗略测定X气体中SO2的体积分数.改进时可选用的下列仪器为 . a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
网址:http://m.1010jiajiao.com/timu3_id_37242[举报]
校办厂漂白车间需22.4L(标准状况)SO2.化学小组同学依据化学方程式Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回.
(1)化学小组所制得的气体中混有的主要杂质气体可能是
(2)为证实相关分析,化学小组的同学设计了如下实验,对退回气体(X)取样进行认真探究(遇有气体吸收过程,视为全吸收).
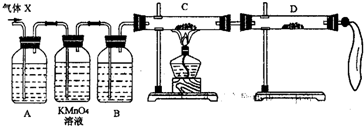
①组装好仪器后,盛放药品前,必要的一个操作是
②A中加入的试剂可能是:
③可证实气体X中混有较多量某杂质气体的实验现象是
(3)对上述装置略加改进,可粗略测定X气体中SO2的体积分数.改进时可选用的下列仪器为
A 导管 B 水槽 C 广口瓶 D 容量瓶 E 量筒 F 单孔塞 G 双孔塞.
查看习题详情和答案>>
| ||
(1)化学小组所制得的气体中混有的主要杂质气体可能是
H2
H2
(填分子式).产生这种结果的主要原因是随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2.
随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2.
.(2)为证实相关分析,化学小组的同学设计了如下实验,对退回气体(X)取样进行认真探究(遇有气体吸收过程,视为全吸收).

①组装好仪器后,盛放药品前,必要的一个操作是
检查装置气密性
检查装置气密性
.②A中加入的试剂可能是:
品红试液
品红试液
,作用是:确认SO2存在
确认SO2存在
.B中加入的试剂可能是:浓H2SO4
浓H2SO4
,作用是:干燥氢气
干燥氢气
.③可证实气体X中混有较多量某杂质气体的实验现象是
黑色CuO粉末变红色,无水硫酸铜变蓝色
黑色CuO粉末变红色,无水硫酸铜变蓝色
.(3)对上述装置略加改进,可粗略测定X气体中SO2的体积分数.改进时可选用的下列仪器为
ACEG
ACEG
(填代号).A 导管 B 水槽 C 广口瓶 D 容量瓶 E 量筒 F 单孔塞 G 双孔塞.
校办厂漂白车间需22.4L(标准状况)SO2.化学小组同学依据化学方程式Zn+2H2SO4(浓)
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回.
(1)化学小组所制得的气体中混有的主要杂质气体可能是______(填分子式).产生这种结果的主要原因是______.
(2)为证实相关分析,化学小组的同学设计了如下实验,对退回气体(X)取样进行认真探究(遇有气体吸收过程,视为全吸收).
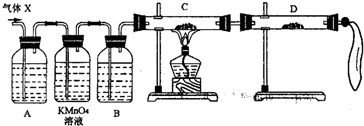
①组装好仪器后,盛放药品前,必要的一个操作是______.
②A中加入的试剂可能是:______,作用是:______.B中加入的试剂可能是:______,作用是:______.
③可证实气体X中混有较多量某杂质气体的实验现象是______.
(3)对上述装置略加改进,可粗略测定X气体中SO2的体积分数.改进时可选用的下列仪器为______(填代号).
A 导管 B 水槽 C 广口瓶 D 容量瓶 E 量筒 F 单孔塞 G 双孔塞.
查看习题详情和答案>>
| ||
(1)化学小组所制得的气体中混有的主要杂质气体可能是______(填分子式).产生这种结果的主要原因是______.
(2)为证实相关分析,化学小组的同学设计了如下实验,对退回气体(X)取样进行认真探究(遇有气体吸收过程,视为全吸收).

①组装好仪器后,盛放药品前,必要的一个操作是______.
②A中加入的试剂可能是:______,作用是:______.B中加入的试剂可能是:______,作用是:______.
③可证实气体X中混有较多量某杂质气体的实验现象是______.
(3)对上述装置略加改进,可粗略测定X气体中SO2的体积分数.改进时可选用的下列仪器为______(填代号).
A 导管 B 水槽 C 广口瓶 D 容量瓶 E 量筒 F 单孔塞 G 双孔塞.
校办厂漂白车间需22.4L(标准状况)SO2.化学小组同学依据化学方程式Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回.
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回.
(1)化学小组所制得的气体中混有的主要杂质气体可能是______(填分子式).产生这种结果的主要原因是______.
(2)为证实相关分析,化学小组的同学设计了如下实验,对退回气体(X)取样进行认真探究(遇有气体吸收过程,视为全吸收).
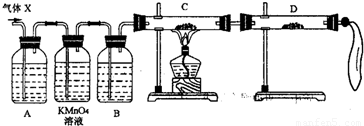
①组装好仪器后,盛放药品前,必要的一个操作是______.
②A中加入的试剂可能是:______,作用是:______.B中加入的试剂可能是:______,作用是:______.
③可证实气体X中混有较多量某杂质气体的实验现象是______.
(3)对上述装置略加改进,可粗略测定X气体中SO2的体积分数.改进时可选用的下列仪器为______(填代号).
A 导管 B 水槽 C 广口瓶 D 容量瓶 E 量筒 F 单孔塞 G 双孔塞.
查看习题详情和答案>>
 ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回.
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回.(1)化学小组所制得的气体中混有的主要杂质气体可能是______(填分子式).产生这种结果的主要原因是______.
(2)为证实相关分析,化学小组的同学设计了如下实验,对退回气体(X)取样进行认真探究(遇有气体吸收过程,视为全吸收).

①组装好仪器后,盛放药品前,必要的一个操作是______.
②A中加入的试剂可能是:______,作用是:______.B中加入的试剂可能是:______,作用是:______.
③可证实气体X中混有较多量某杂质气体的实验现象是______.
(3)对上述装置略加改进,可粗略测定X气体中SO2的体积分数.改进时可选用的下列仪器为______(填代号).
A 导管 B 水槽 C 广口瓶 D 容量瓶 E 量筒 F 单孔塞 G 双孔塞.
查看习题详情和答案>>
校办厂漂白车间需22.4L(标准状况)SO2.化学小组同学依据化学方程式Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回.
ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(ρ=1.84g/cm3)110mL充分反应,锌全部溶解后,即将收集所得气体如数送至车间,不料经质检科检验存在严重质量问题,气体随即被退回.
(1)化学小组所制得的气体中混有的主要杂质气体可能是______(填分子式).产生这种结果的主要原因是______.
(2)为证实相关分析,化学小组的同学设计了如下实验,对退回气体(X)取样进行认真探究(遇有气体吸收过程,视为全吸收).
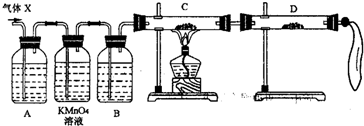
①组装好仪器后,盛放药品前,必要的一个操作是______.
②A中加入的试剂可能是:______,作用是:______.B中加入的试剂可能是:______,作用是:______.
③可证实气体X中混有较多量某杂质气体的实验现象是______.
(3)对上述装置略加改进,可粗略测定X气体中SO2的体积分数.改进时可选用的下列仪器为______(填代号).
A 导管 B 水槽 C 广口瓶 D 容量瓶 E 量筒 F 单孔塞 G 双孔塞.
查看习题详情和答案>>
环保部门对某硫酸厂排放废气中SO2的含量进行如下测定:取标准状况下含有SO2的废气1.00L,缓慢通过足量溴水(化学方程式为:Br2+SO2+2H2O═H2SO4+2HBr),在所得溶液中加入过量的BaCl2溶液,生成白色沉淀.将沉淀过滤、洗涤、干燥,称得其质量为0.233g.试计算:
(1)该废气样品中SO2的体积分数为
(2)若将用溴水吸收所得溶液稀释成100mL,则所得稀释液中H2SO4的物质的量浓度为
(3)该硫酸厂每天排放的SO2总量为32kg,若用石灰乳吸收该硫酸厂所排放的SO2,且生成CaSO3,则理论上每天需消耗Ca(OH)2的质量为
查看习题详情和答案>>
(1)该废气样品中SO2的体积分数为
22.4%
22.4%
.(2)若将用溴水吸收所得溶液稀释成100mL,则所得稀释液中H2SO4的物质的量浓度为
0.1
0.1
mol/L.(3)该硫酸厂每天排放的SO2总量为32kg,若用石灰乳吸收该硫酸厂所排放的SO2,且生成CaSO3,则理论上每天需消耗Ca(OH)2的质量为
37
37
kg.