摘要:( B )19.实验室配制硫酸铁溶液时.先把硫酸铁晶体溶解在稀硫酸中.再加水稀释至所需浓度.如此操作的目的是 A.防止硫酸铁分解 B.抑制硫酸铁水解C.提高溶液的pH D.提高硫酸铁的溶解度 ( C )20.下列说法中正确的是 A.HCO3-在水溶液中只电离.不水解 B.硝酸钠溶液水解后呈中性 C.可溶性的铝盐都能发生水解反应 D.可溶性的钠盐都不发生水解反应 ( B )21.下列叙述中.正确的是 A.由极性键构成的一定是极性分子 B.由非极性键构成的一定是非极性分子 C.非极性分子中一定不含极性键 D.极性分子中一定不含非极性键 ( C )22.NH4Cl溶液的pH和稀HCl的pH值均为5.其中由水电离出的c(H+)分别为amol/L和bmol/L.则a与b的关系正确的是 A.a=b B.a<b C.a>b D.不能确定23.在10mL0.1mol/L的醋酸中逐滴加入0.1mol/L的氢氧化钠溶液.当滴至混合液恰好呈中性时.消耗氢氧化钠溶液的体积 A.等于10mL B.小于10mL C.大于10mL D.无法判断 (CD)24.物质的量浓度相同的下列各溶液等体积混合后.溶液的pH大于7的是 A.NaHCO3.HCl.NaCl B.K2CO3.H2SO4 C.Na2CO3.CH3COONa.HNO3 D.NaOH.CH3COONa.HCl ( A )25.将氨水逐滴加入到稀盐酸中.使溶液成中性.则此时 A.c(NH4+)==c(Cl-) B.c(NH4+)>c(Cl-) C.c(NH4+)<c(Cl-) D.c(NH4+)与c(Cl-)之间关系不确定 ( B )26.将pH=3的盐酸溶液和pH=11的氨水等体积混合后.溶液中离子浓度关系正确的是 A.c(NH4+)>c(Cl-)>c(H+)>c(OH-) B.c(NH4+)>c(Cl-)> c(OH-)>c(H+) C.c(Cl-)>c(NH4+)>c(H+)>c(OH-) D.c(Cl-)>c(NH4+)>c(OH-)>c(H+) (AB)27.将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合.测得混合溶液中c(Na+)>c(X-).则下列关系错误的是 A.c(OH-)<c(H+) B.c(HX)<c(X-) C.c(X-)+c(HX)==2c(Na+) D.c(HX)+c(H+)==c(Na+)+c(OH-) (BD)28.一元酸HA溶液中.加入一定量强碱MOH溶液后.恰好完全反应.反应后的溶液中.下列判断正确的是 A.c(A-)≥c(M+) B.c(A-)≤c(M+) C.若MA不水解.则c(OH-)<c(H+) D.若MA水解.则c(OH-)>c(H+) ( B )29.已知反应A2(g) + 2B2(g) 2AB2(g) 的△H<0.下列说法正确的是 A.升高温度.正向反应速率增加.逆向反应速率减小 B.升高温度有利于反应速率增加.从而缩短达到平衡的时间 C.达到平衡后.升高温度或增大压强都有利于该反应平衡正向移动 D.达到平衡后.降低温度或减小压强都有利于该反应平衡正向移动 ( C )30. 某温度下在密闭容器中发生如下反应:2M2E(g).若开始时只充入2mol -3- E(g).达平衡时.混合气体的压强比起始时增大了20%,若开始时只充入2mol M和1mol N 的混合气体.达平衡时M的转化率 A.20% B.40% C.60% D.80% ( A )31. 0.1 mol·L-1盐酸分别跟20 mL NaOH和20 mL NH3·H2O反应.都消耗了20 mL 盐酸.这表明NaOH溶液和氨水的关系 A. 物质的量浓度相同 B. 氢氧根离子浓度相同 C. pH相同 D. 溶液中离子浓度相同
网址:http://m.1010jiajiao.com/timu3_id_371967[举报]
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用图4-19电解实验可制得白色的纯净Fe(OH)2沉淀,两电极的材料分别为石墨和铁。

图4-19
(1)a电极材料应为_________;b电极材料为________。b电极的电极反应式为_______。
(2)电解液c可以是(填编号)__________________。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为_______________,在加入苯之前,对c溶液应作何简单处理?
(4)为了在较短时间内看到白色沉淀,可采取的措施有____________。
A.改用稀硫酸作电解液 B.适当增大电源的电压
C.适当减小两电极间的距离 D.适当降低电解液的浓度
查看习题详情和答案>>
三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]?3H2O可用于摄影和蓝色印刷.可用如下流程来制备.
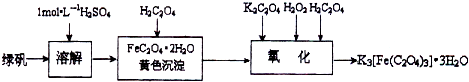
根据题意完成下列各题:
(1)若用铁和稀硫酸制备FeSO4?7H2O (填物质名称)往往要过量,理由是 .
(2)要从溶液中得到绿矾,必须进行的实验操作是 .(按前后顺序填)
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某课外化学兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?3H2O)中铁元素含量,做了如下实验:
步骤一:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO-4.被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4,被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液19.98ml;
回答43-46小题:
(3)配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有 ;主要操作步骤依次是:称量、 、转移、 、定容、摇匀.
(4)加入锌粉的目的是 .
(5)实验测得该晶体中铁的质量分数为 .在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量 .(选填“偏低”“偏高”“不变”)
(6)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体.研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式 .
查看习题详情和答案>>

根据题意完成下列各题:
(1)若用铁和稀硫酸制备FeSO4?7H2O
(2)要从溶液中得到绿矾,必须进行的实验操作是
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某课外化学兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?3H2O)中铁元素含量,做了如下实验:
步骤一:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO-4.被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4,被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/LKMnO4溶液19.98ml;
回答43-46小题:
(3)配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有
(4)加入锌粉的目的是
(5)实验测得该晶体中铁的质量分数为
(6)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体.研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式
某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:
①取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;
②过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;
③将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;
④然后以0.10mol?L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液.
发生的反应为:
(1)配平上述方程式
(2)KMnO4溶液应盛在
(3)若滴定管的规格为25mL,滴定前滴定管中液面的读数为5.20mL,则滴定管中液体的体积为
A.5.20mL B.19.80mL C.大于19.80mL D.小于19.80mL
(4)本实验是否需要外加指示剂?
(5)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(6)该牛奶中钙的含量为
查看习题详情和答案>>
①取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;
②过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;
③将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;
④然后以0.10mol?L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液.
发生的反应为:
5
5
H2C2O4+2
2
KMnO4+3
3
H2SO4═10
10
CO2↑+2
2
MnSO4+1
1
K2SO4+3
3
H2O (1)配平上述方程式
(2)KMnO4溶液应盛在
酸式
酸式
(填“酸式”或“碱式”)滴定管中.(3)若滴定管的规格为25mL,滴定前滴定管中液面的读数为5.20mL,则滴定管中液体的体积为
C
C
(填代号).A.5.20mL B.19.80mL C.大于19.80mL D.小于19.80mL
(4)本实验是否需要外加指示剂?
否
否
(填“是”或者“否”).到达滴定终点时,溶液的颜色由紫红
紫红
色变为无
无
色.(5)滴定时边滴边摇动锥形瓶,眼睛应观察
B
B
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(6)该牛奶中钙的含量为
120
120
mg/100mL.为了研究温度对苯催化加氢生成环己烷(C6H12)的影响,以检验新型镍催化剂的性能,采用恒压微型反应装置进行如下实验,在反应时间等其他条件相同时,定时取样分离出氢气后,分析成分如下:
| ||||||||||||||||||||||||||
查看习题详情和答案>>
(2011?临沂模拟)乙酰水杨酸即阿斯匹林(aspirin),是19世纪末合成成功的,作为一个有效的解热止痛、治疗感冒的药物,至今仍广泛使用,有关报道表明,人们正在发现它的某些新功能.阿斯匹林是由水杨酸(邻羟基苯甲酸)与醋酸酐进行酯化反应而得的,装置如右图所示:
实验步骤:

主要试剂和产品的物理常数:
根据上述信息回答下列问题:
(1)制取过程中所用乙酸酐要使用新蒸馏的乙酸酐,分析可能原因:
(2)步骤①加热的方法为
(3)第④步加入加入饱和NaHCO3的作用为
(4)得到的产品中通常含有水杨酸,主要原因是
(5)1mol阿司匹林与足量的NaOH溶液共热,充分反应,有
查看习题详情和答案>>

实验步骤:

主要试剂和产品的物理常数:
| 名 称 | 分子量 | m.p.或b.p. | 水 | 醇 | 醚 |
| 水杨酸 | 138 | 158(s) | 微 | 易 | 易 |
| 醋酐 | 102.09 | 139.35(l) | 易 | 溶 | ∞ |
| 乙酰水杨酸 | 180.17 | 135(s) | 溶、热 | 溶 | 微 |
(1)制取过程中所用乙酸酐要使用新蒸馏的乙酸酐,分析可能原因:
长时间放置的乙酸酐遇空气中的水,容易分解成乙酸,所以在使用前必须重新蒸馏
长时间放置的乙酸酐遇空气中的水,容易分解成乙酸,所以在使用前必须重新蒸馏
(2)步骤①加热的方法为
85~90℃水浴
85~90℃水浴
,此操作有何优点:受热均匀且易控制温度
受热均匀且易控制温度
(3)第④步加入加入饱和NaHCO3的作用为
与乙酰水杨酸的羧基反应
与乙酰水杨酸的羧基反应
(4)得到的产品中通常含有水杨酸,主要原因是
水杨酸乙酰化不完全以及产物分离过程中水解
水杨酸乙酰化不完全以及产物分离过程中水解
(5)1mol阿司匹林与足量的NaOH溶液共热,充分反应,有
3
3
NaOH参加了反应.