网址:http://m.1010jiajiao.com/timu3_id_371584[举报]
A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
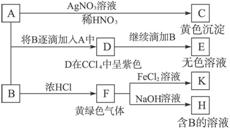
请完成下列问题:
(1)写出A、B和C的化学式:A_____________,B_____________,C_____________。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:______________________________________,_______________________________________。
(3)将SO2气体通入D溶液,D溶液变为无色,生成两种酸。写出反应的离子方程式:______________________________________________________________________________。
(4)写出由F→H的化学方程式:__________________________________________________。
查看习题详情和答案>>已知强碱和弱酸反应生成的盐的溶液呈碱性。A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下列为相关的实验步骤和实验现象: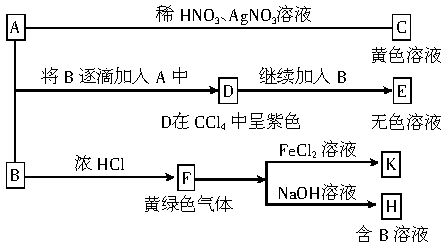
(1)写出B和C的化学式:B____________,C__________。
(2)写出D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:_________________________。
(3)将SO2气体通入D的水溶液,D的水溶液变为无色,生成两种酸。写出反应的离子方程式:_____________________。
(4)写出F→H的化学方程式:______________。
某同学想利用如图所示的装置探究
SO2的性质,现邀请你一同参与.
(1)实验前应先检验装置的气密性,具体的方法是________.
(2)该同学选用亚硫酸钠固体与硫酸加热反应制取SO2气体,该反应的化学方程式为________.
(3)分别将SO2气体通入盛有下列溶液的试管中,请你根据现象回答下列问题:
①溶液C是紫色石蕊溶液,可以观察到的现象是________,继续通入过量的SO2气体,观察到的现象又是________,说明SO2________;
②溶液C是品红溶液,试管中出现的现象是________,加热试管时观察到的现象是________,说明SO2________;
③溶液C是澄清石灰水,慢慢将SO2通入其中,试管中出现的现象是________,相应的化学方程式为________.
(4)若要设计实验验证SO2的还原性,实验室中现有下列实验用品:氢硫酸、NaOH溶液、KMnO4溶液、脱脂棉、镊子、pH试纸、玻璃棒.选择合适的用品,简述实验的操作步骤和现象.
某同学用如下图Ⅰ所示的装置来探究SO2的性质及有关实验.

(1)实验前应先检验装置的气密性,方法是________
(2)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,写出该反应的化学方程式________
(3)分别将SO2气体通入下列C溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液,现象是________,继续通入过量的SO2气体,现象是________.
②SO2通入紫红色KMnO4溶液,现象是________,写出反应的离子方程式________.
③SO2慢慢通入(可以1个气泡1个气泡地通入)澄清石灰水中,现象________.
④SO2通入少量的澄清石灰水中,没有明显现象,产生此现象的原因是________.
(4)若该同学制取的SO2气体中混有CO2气体,请你设计实验证明混合气体中既有SO2气体,又有CO2气体.
可以选择图Ⅱ洗气装置设计实验.洗气装置里的溶液是:A浓硫酸、B氢氧化钠溶液、C硫酸铜溶液、D品红溶液、E澄清石灰水、F高锰酸钾溶液、G碳酸氢钠溶液.
上述装置的连接顺序是(用字母表示,所给装置可以重复使用,有些装置也可以不用)________.
| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |
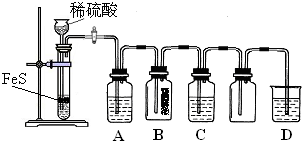
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为
②B中的现象是
③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为
④D中盛放的试剂可以是
a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
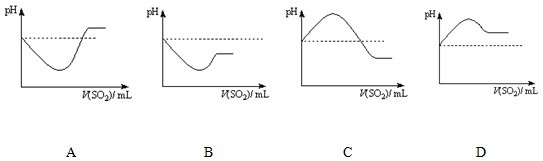
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应