网址:http://m.1010jiajiao.com/timu3_id_37091[举报]
(1)过碳酸钠 (化学式2Na2CO3?3H2O2) 俗称固体双氧水,白色结晶颗粒.过碳酸钠溶于水或受热时,分解生成碳酸钠和过氧化氢,是很好的固体氧释放剂.
①请你写出过氧化氢的电子式


②H2O2有时可作为矿业废物消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为
③某强酸性反应体系中,反应物和生成物共六种物质;O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式
④实验室制O2主要有4种方法,用化学方程式写出任意一种
| ||
| ||
(2)碳酸钠水溶液显碱性.用离子方程式解释其原因
(3)漂白剂亚氯酸钠 (NaClO2) 在常温黑暗处可保存一年.亚氯酸不稳定可分解,反应的离子方程式为:
HClO2→ClO2↑+H++Cl-+H2O(未配平).在该反应中,当有1molClO2生成时,转移的电子数是
(4)ClO2不稳定,可与NaOH溶液、H2O2反应,转化为较稳定的亚氯酸钠 (NaClO2).该反应的化学方程式为
自2009年3月起,从墨西哥、美国等国逐渐扩散到全世界的甲型H1N1型流感爆发疫情,引起全球关注和积极应对.防控专家表示,含氯消毒剂和过氧化物等强氧化性消毒剂可预防甲型H1N1型流感.
(1)过碳酸钠 (化学式2Na2CO3?3H2O2) 俗称固体双氧水,白色结晶颗粒.过碳酸钠溶于水或受热时,分解生成碳酸钠和过氧化氢,是很好的固体氧释放剂.
①请你写出过氧化氢的电子式______,其中氧元素的化合价是______.
②H2O2有时可作为矿业废物消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为______,H2O2被称为“绿色氧化剂”的理由是______.
③某强酸性反应体系中,反应物和生成物共六种物质;O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式______.
④实验室制O2主要有4种方法,用化学方程式写出任意一种______.
(2)碳酸钠水溶液显碱性.用离子方程式解释其原因______;pH值相同的①碳酸钠溶液、②醋酸钠溶液、③氢氧化钠溶液,其浓度由大到小的顺序是:______(填写序号).
(3)漂白剂亚氯酸钠 (NaClO2) 在常温黑暗处可保存一年.亚氯酸不稳定可分解,反应的离子方程式为:
HClO2→ClO2↑+H++Cl-+H2O(未配平).在该反应中,当有1molClO2生成时,转移的电子数是______个.
(4)ClO2不稳定,可与NaOH溶液、H2O2反应,转化为较稳定的亚氯酸钠 (NaClO2).该反应的化学方程式为______.
查看习题详情和答案>>
(14分)近年来,在超临界CO2(临界温度Tc = 304.3K;临界压力pc = 72.8×105Pa)中的反应引起广泛关注。该流体的密度在临界点附近很容易调制,可认为是一种替代有机溶剂的绿色溶剂,该溶剂早已用于萃取咖啡因。然而,利用超临界CO2的缺点之一是CO2必须压缩。
10-1 计算将CO2从1bar压缩到50bar所需的能量,其最终体积为50ml,温度为298K,设为理想气体。
10-2 实际气体用如下方程描述(近似的):
[p+a(n/V)2](V-nb) = nRT
对于CO2:a =3.59×105 Padm6mol-2 b = 0.0427dm3mol-1
分别计算在温度为305K和350K下为达到密度220gdm-3,330 gdm-3,440 gdm-3所需的压力。
10-3 超临界流体的性质,如二氧化碳的溶解能力和反应物的扩散性与液体的密度关系密切,上问的计算表明,在哪一区域――近临界点还是在较高压力或温度下更容易调制流体的密度?
10-4 在超临界二氧化碳中氧化醇类,如将苄醇氧化为苯甲醛,是一种超临界工艺,反应在催化选择性效率为95%的Pd/Al2O3催化剂作用下进行。
(1)写出主要反应过程的配平的反应式。
(2)除完全氧化外,进一步氧化时还发生哪些反应?
10-5 在另一超流体工艺合成有机碳酸酯和甲酰胺的例子中,二氧化碳既是溶剂又可作为反应物替代光气或一氧化碳。
(1)写出甲醇和二氧化碳反应得到碳酸二甲酯的配平的化学反应方程式,如以光气为反应物如何得到碳酸二甲酯?
(2)用适当的催化剂可用吗啉和二氧化碳合成甲酰基吗啉。该反应还需添加什么反应物?写出反应式;若用一氧化碳替代,反应式如何?
10-6 用绿色化学的观念给出用二氧化碳代替一氧化碳和光气的两个理由。与以CO或COCl2为反应物对比,再给出用CO2为反应物的1个主要障碍(除必须对二氧化碳进行压缩外)
注:吗啉的分子式为C4H9NO;结构式为:![]()
雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
⑴As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,该反应的化学方程式为 。
⑵上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
⑶As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 极附近逸出。
⑷将⑶中反应产物NO2充满干燥的烧瓶,然后将烧瓶倒立于少水槽中,向烧瓶中通入一定量的氧气,气体恰好完全溶于水(假设溶液没有扩散),则烧瓶中溶液溶质的物质的量浓度为 (设该条件下的气体摩尔体积为23.8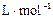 ,结果保留到小数点后三位)。
,结果保留到小数点后三位)。
雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,该反应的化学方程式为________.
(2)上述反应中的氧化剂是________,反应产生的气体可用________吸收.
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO![]() =2H3AsO4+3S+10NO2↑+2H2O,若生成2 mol H3AsO4,则反应中转移电子的物质的量为________.若将该反应设计成一原电池,则NO2应该在________极附近逸出.
=2H3AsO4+3S+10NO2↑+2H2O,若生成2 mol H3AsO4,则反应中转移电子的物质的量为________.若将该反应设计成一原电池,则NO2应该在________极附近逸出.
(4)将(3)中反应产物NO2充满干燥的烧瓶,然后将烧瓶倒立于少水槽中,向烧瓶中通入一定量的氧气,气体恰好完全溶于水(假设溶液没有扩散),则烧瓶中溶液溶质的物质的量浓度为________(设该条件下的气体摩尔体积为23.8 L·mol-1,结果保留到小数点后三位).