摘要:读X.Y.Z三个外资的企业生产.销售示意图.回答4--5题. 4.三家外企在中国选址考虑的最主要区位因子是 A.市场因子 B.原料因子 C.劳动力因子 D.技术因子 5.X.Y.Z对应的工业部门最可能是 A.纺织.汽车.服装 B.钢铁.服装.纺织 C.汽车.制鞋.电子装配 D.纺织.电子装配.钢铁
网址:http://m.1010jiajiao.com/timu3_id_37080[举报]
 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:2型氢化物分子中既有σ键又有π键,所有原子共平面.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制化合物M(M可看做一种含氧酸盐).经X射线分析,M晶体的最小重复单元为正方体(如图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
(1)Y2+的结构示意图


3d24s2
3d24s2
.(2)X在该氢化物中以
sp2
sp2
方式杂化;X和Y形成的化合物YX2的电子式为

(3)①制备M的化学反应方程式是
TiO2+BaCO3
BaTiO3+CO2↑
| ||
TiO2+BaCO3
BaTiO3+CO2↑
;
| ||
②在M晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的
面心
面心
;③已知O2-半径为1.4×10-10 m,Z4+的半径为6.15×10-11m,阿佛加德罗常数为NA,则M的密度为
| 233g/mol |
| (4.03×10-8 cm)3NA |
| 233g/mol |
| (4.03×10-8 cm)3NA |
化学反应与能量有比不可分的关系,回答下列问题.
Ⅰ:已知31g白磷变为31g红磷释放能量.试回答:
(1)上述变化属于
(2)31g白磷具有的能量_
(3)31g白磷完全燃烧释放的能量_
Ⅱ:A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
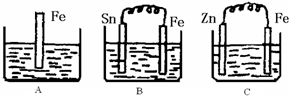
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A
(2)一段时间后,B中Sn极附近溶液的pH
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
Ⅲ:某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: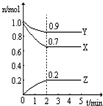
(1)该反应的化学方程式为
(2)反应开始至2min,以气体Z表示的平均反应速率为
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时
查看习题详情和答案>>
Ⅰ:已知31g白磷变为31g红磷释放能量.试回答:
(1)上述变化属于
化学
化学
(填“物理”或“化学”)变化.(2)31g白磷具有的能量_
>
>
(“>”或“<”)31g红磷具有的能量,常温常压下,红磷
红磷
更稳定.(3)31g白磷完全燃烧释放的能量_
>
>
(“>”或“<”)31g红磷完全燃烧释放的能量.Ⅱ:A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸

(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
;BFe-2e-═Fe2+
Fe-2e-═Fe2+
;C2H++2e-═H2↑
2H++2e-═H2↑
.(2)一段时间后,B中Sn极附近溶液的pH
pH增大
pH增大
(填“增大”、“减小”、“不变”).(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=
0.75
0.75
mol?L-1.此时,三个烧杯中液体质量由大到小的顺序为:C>A=B
C>A=B
(填写序号).(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是
BAC
BAC
(填写序号).Ⅲ:某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(1)该反应的化学方程式为
3X+Y 2Z
2Z
 2Z
2Z3X+Y 2Z
2Z
. 2Z
2Z(2)反应开始至2min,以气体Z表示的平均反应速率为
0.05mol/(L.min)
0.05mol/(L.min)
.(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的
0.9
0.9
倍;②达平衡时,容器内混合气体的平均相对分子质量比起始投料时
增大
增大
(填“增大”“减小”或“相等”).A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比3:4,D分别与A、B、C可形成10个电子的分子X、Y、Z.则下列叙述正确的是( )
| A、X、Y、Z三种分子的稳定性逐渐减弱 | B、上述四种元素共能形成五种单质 | C、X、Y、Z三种分子的沸点逐渐升高 | D、X、Y、Z三种分子均为极性分子 |
设X、Y、Z代表3种元素.已知:
①X+和Y-两种离子具有相同的电子层结构;
②Z元素原子核内质子数比Y原子核内质子数少9个;
③Y和Z两种元素可以形成4核42个电子的负一价阴离子.
据此,请填空:
(1)写出X、Y、Z三种元素的名称X
(2)写出X、Y两种元素最高价氧化物对应水化物相互反应的离子方程式:
查看习题详情和答案>>
①X+和Y-两种离子具有相同的电子层结构;
②Z元素原子核内质子数比Y原子核内质子数少9个;
③Y和Z两种元素可以形成4核42个电子的负一价阴离子.
据此,请填空:
(1)写出X、Y、Z三种元素的名称X
钾
钾
,Y氯
氯
,Z氧
氧
.(2)写出X、Y两种元素最高价氧化物对应水化物相互反应的离子方程式:
OH-+H+═H2O
OH-+H+═H2O
.已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素的符号是
(2)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
(3)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低
查看习题详情和答案>>
(1)X元素的符号是
As
As
该原子基态时的电子排布式为1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p3
.(2)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
_.(3)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低
NH3>PH3>AsH3
NH3>PH3>AsH3
,理由是键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定
键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定
.