摘要:从电石开始.可以发生如下图所示的一系列变化: (1)写出电石与水反应的化学方程式 , (2)气体A为 分子.气体B为 分子. (3)写出生成高聚物C的化学方程式 , (4)实验室制得的气体A中常含有H2S.PH3等杂质.除杂所用试剂为 , (5)“D→E 是工业上生产漂白精的主要原理.请写出这一过程的离子方程式: .
网址:http://m.1010jiajiao.com/timu3_id_37023[举报]
某课外小组设计了如图所示的实验装置,进行气体性质实验.图中箭头表示气体流向.A表示一种纯净、干燥的气体,B是另一种气体,反应进行一段时间后,装置己中有红棕色气体生成.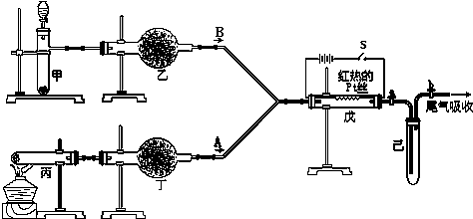
实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和浓盐酸、蒸馏水.
根据图中装置和反应现象回答:
(1)充分反应后丙中无固体物质剩余,发生反应的化学方程式为
(2)丁中的干燥剂应选
(3)甲中发生反应的化学方程式为
(4)观察到反应开始后断开电键S,铂丝能继续保持红热,戊中发生的主要反应的化学方程式为
(5)若装置的气密性良好,甲、丙中均有气体产生,其余试剂选择正确,操作正常,但己中未观察到红棕色,可能的原因是
查看习题详情和答案>>

实验中所用的药品和干燥剂只能从下列物质中选取:Na2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和浓盐酸、蒸馏水.
根据图中装置和反应现象回答:
(1)充分反应后丙中无固体物质剩余,发生反应的化学方程式为
NH4HCO3
NH3↑+CO2↑+H2O
| ||
NH4HCO3
NH3↑+CO2↑+H2O
;
| ||
(2)丁中的干燥剂应选
碱石灰
碱石灰
,不选另一种干燥剂的理由是因为无水CaCl2可以与氨络合而无法得到氨气
因为无水CaCl2可以与氨络合而无法得到氨气
;(3)甲中发生反应的化学方程式为
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
;(4)观察到反应开始后断开电键S,铂丝能继续保持红热,戊中发生的主要反应的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| 加热 |
4NH3+5O2
4NO+6H2O
,此反应是(吸热、放热)
| ||
| 加热 |
放热
放热
反应;(5)若装置的气密性良好,甲、丙中均有气体产生,其余试剂选择正确,操作正常,但己中未观察到红棕色,可能的原因是
甲中产生的气体太少
甲中产生的气体太少
.(1)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图所示.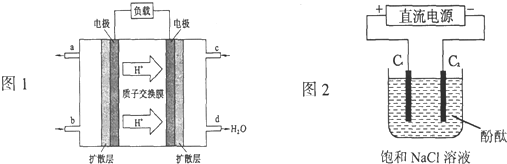
①请写出从C口通入O2发生的电极反应式
②以石墨电极电解饱和食盐水,电解开始后在
(2)合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2O 投入某10L密闭容器,5min时达平衡,各物质浓度(mol?L-1)变化如下:
①请分别计算CO和CO2的平衡浓度
②CO的平衡转化率为
a.增加压强 b.降低温度 c.体积不变,再充入CO d.更换催化剂 e.体积不变,再充入0.1molH2O
③若5min~10min只改变了某一条件,该条件是
查看习题详情和答案>>

①请写出从C口通入O2发生的电极反应式
O2+4e-+4H+=2H2O
O2+4e-+4H+=2H2O
.②以石墨电极电解饱和食盐水,电解开始后在
阴极
阴极
的周围(填“阴极”或“阳极”)先出现红色.假设电池的理论效率为80%(电池的理论效率是指电池产生的最大电能与电池反应所释放的全部能量之比),若消耗6.4g甲醇气体,外电路通过的电子个数为5.8×1023
5.8×1023
(保留两位有效数字).(2)合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2O 投入某10L密闭容器,5min时达平衡,各物质浓度(mol?L-1)变化如下:
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
0.006 mol?L-1
0.006 mol?L-1
,0.004 mol?L-1
0.004 mol?L-1
.②CO的平衡转化率为
40%
40%
,欲提高CO的转化率,下列措施中可行的是be
be
(填序号).a.增加压强 b.降低温度 c.体积不变,再充入CO d.更换催化剂 e.体积不变,再充入0.1molH2O
③若5min~10min只改变了某一条件,该条件是
H2O的浓度
H2O的浓度
,如何改变的增大了0.01 mol?L-1
增大了0.01 mol?L-1
.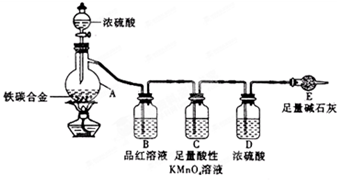 某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.Ⅰ探究浓硫酸的某些性质
(1)按图示连接装置,检查装置的气密性,称量E的质量.
(2)将a g铁碳合金样品放入A中,再加入适量的浓硫酸.仪器A的名称为
蒸馏烧瓶
蒸馏烧瓶
,未点燃酒精灯前,A、B均无明显现象,其原因是:
常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应
常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应
.(3)点燃酒精灯一段时间后,A、B中可观察到明显现象.
A中开始发生反应的化学方程式为:2Fe+6H2SO4
| △ |
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
(写化学方程式).
| ||
B中的现象是
品红溶液褪色
品红溶液褪色
,由此可得到浓硫酸具有强氧化性
强氧化性
性,C装置的作用除去二氧化硫并检验二氧化硫以除尽
除去二氧化硫并检验二氧化硫以除尽
.(4)随着反应的进行,A中还可能发生某些离子反应.写出相应的离子方程式
Fe+2H+=Fe2+H2↑
Fe+2H+=Fe2+H2↑
.(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是
碳铁合金在酸溶液中形成原电池
碳铁合金在酸溶液中形成原电池
.Ⅱ测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重.E增重b g.
铁碳合金中铁的质量分数为
1-
| 3b |
| 11a |
1-
(写表达式),为使实验数据更为精确,可在装有碱石灰的干燥管后加入| 3b |
| 11a |
另一个装有碱石灰的干燥管
另一个装有碱石灰的干燥管
.(2013?泰安三模)钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料.以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti.工业流程如图1所示:

(1)粗TiC14中含有少量FeCl3、SiCl4等,它们的部分性质如下:
从粗TiC14中精制TiC14的方法是
(2)写出用惰性电极电解熔融NaCl时阳极的电极反应式:
(3)Ti可溶解在浓HF溶液中,请完成下列离子方程式:
+
(4)如图2所示是一个制取氯气并以氯气为原料进行反应的装置.
①装置A中发生反应的化学方程式为
②在实验室中,某同学欲用如图3所示装置净化氯气,则M、N中应盛放的试剂分别是
③实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃C处酒精灯.Cl2通过装置M、N再进入装置C,与装置C中的固体粉末发生氧化还原反应生成CO气体.试写出装置C中发生反应的化学方程式:
查看习题详情和答案>>

(1)粗TiC14中含有少量FeCl3、SiCl4等,它们的部分性质如下:
| 物质 | 沸点/℃ | 在水中 | 在乙醚中 |
| TiC14 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
B
B
(填字母).A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液(2)写出用惰性电极电解熔融NaCl时阳极的电极反应式:
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
;阴极产物是钠
钠
.(3)Ti可溶解在浓HF溶液中,请完成下列离子方程式:
1
1
Ti+6
6
HF═1
1
Ti| F | 2- 6 |
2
2
H+
H+
+2
2
H2↑(4)如图2所示是一个制取氯气并以氯气为原料进行反应的装置.
①装置A中发生反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
②在实验室中,某同学欲用如图3所示装置净化氯气,则M、N中应盛放的试剂分别是
饱和食盐水
饱和食盐水
、浓硫酸
浓硫酸
.(填试剂名称)③实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃C处酒精灯.Cl2通过装置M、N再进入装置C,与装置C中的固体粉末发生氧化还原反应生成CO气体.试写出装置C中发生反应的化学方程式:
TiO2+2Cl2+2C
TiCl4+2CO
| ||
TiO2+2Cl2+2C
TiCl4+2CO
.
| ||
(1)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g)![]() 2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
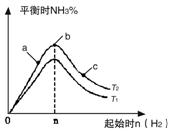
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时H2的转化率为60%,则在起始时体系中加入N2的物质的量为__________mol,此条件下(T2),反应的平衡常数K=__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
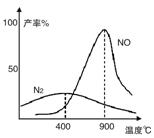
4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
4NH3+3O2![]() 2N2+6H2O
2N2+6H2O
温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是__________。
(3)现以H2与O2、熔融盐Na2CO3组成的燃料电池(如图所示,其中Y为CO2)装置进行电解。
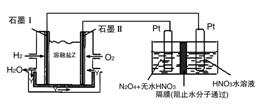
写出石墨Ⅰ电极上发生反应的电极反应式:__________。
在电解池中生成N2O5的电极反应式为:__________。
查看习题详情和答案>>