题目内容
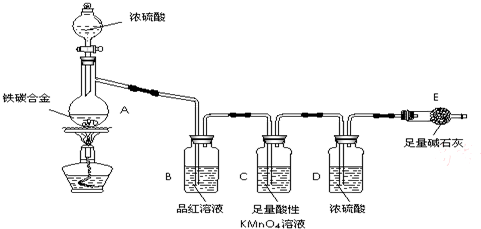
 某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题.Ⅰ探究浓硫酸的某些性质
(1)按图示连接装置,检查装置的气密性,称量E的质量.
(2)将a g铁碳合金样品放入A中,再加入适量的浓硫酸.仪器A的名称为
蒸馏烧瓶
蒸馏烧瓶
,未点燃酒精灯前,A、B均无明显现象,其原因是:
常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应
常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应
.(3)点燃酒精灯一段时间后,A、B中可观察到明显现象.
A中开始发生反应的化学方程式为:2Fe+6H2SO4
| △ |
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
(写化学方程式).
| ||
B中的现象是
品红溶液褪色
品红溶液褪色
,由此可得到浓硫酸具有强氧化性
强氧化性
性,C装置的作用除去二氧化硫并检验二氧化硫以除尽
除去二氧化硫并检验二氧化硫以除尽
.(4)随着反应的进行,A中还可能发生某些离子反应.写出相应的离子方程式
Fe+2H+=Fe2+H2↑
Fe+2H+=Fe2+H2↑
.(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是
碳铁合金在酸溶液中形成原电池
碳铁合金在酸溶液中形成原电池
.Ⅱ测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重.E增重b g.
铁碳合金中铁的质量分数为
1-
| 3b |
| 11a |
1-
(写表达式),为使实验数据更为精确,可在装有碱石灰的干燥管后加入| 3b |
| 11a |
另一个装有碱石灰的干燥管
另一个装有碱石灰的干燥管
.分析:(2)仪器A为蒸馏烧瓶;常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应;
(3)加热条件下,Fe、碳都与浓硫酸反应,碳与浓硫酸反应生成二氧化硫、二氧化碳与水;
二氧化硫具有漂白性,能使品红溶液褪色;
反应中体现浓硫酸的强氧化性;
由装置可知,实验是通过测定E装置碱石灰增重,测定二氧化碳的质量,进而测定铁的含量,碱石灰可以吸收二氧化硫,二氧化硫具有还原性,可以被酸性高锰酸钾氧化二除去,根据颜色变化确定二氧化硫是否除尽;
(4)随反应进行浓硫酸变为稀硫酸,铁与稀硫酸反应生成硫酸亚铁与氢气;
(5)碳铁合金形成原电池,原电池能加快化学反应速率;
(6)根据mg铁碳合金,加入过量浓硫酸,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则可求出mg铁碳合金中含碳元素的质量进而求出铁的质量分数;
E中所装试剂为碱石灰,可吸收空气中CO2、H2O使测定二氧化碳的质量增大,应则E装置后再连接1个装有碱石灰的干燥管.
(3)加热条件下,Fe、碳都与浓硫酸反应,碳与浓硫酸反应生成二氧化硫、二氧化碳与水;
二氧化硫具有漂白性,能使品红溶液褪色;
反应中体现浓硫酸的强氧化性;
由装置可知,实验是通过测定E装置碱石灰增重,测定二氧化碳的质量,进而测定铁的含量,碱石灰可以吸收二氧化硫,二氧化硫具有还原性,可以被酸性高锰酸钾氧化二除去,根据颜色变化确定二氧化硫是否除尽;
(4)随反应进行浓硫酸变为稀硫酸,铁与稀硫酸反应生成硫酸亚铁与氢气;
(5)碳铁合金形成原电池,原电池能加快化学反应速率;
(6)根据mg铁碳合金,加入过量浓硫酸,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则可求出mg铁碳合金中含碳元素的质量进而求出铁的质量分数;
E中所装试剂为碱石灰,可吸收空气中CO2、H2O使测定二氧化碳的质量增大,应则E装置后再连接1个装有碱石灰的干燥管.
解答:解:(2)仪器A为蒸馏烧瓶;常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应,没有二氧化硫生成,故A、B均无明显现象,
故答案为:蒸馏烧瓶;常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应;
(3)加热条件下,Fe、碳都与浓硫酸反应,碳与浓硫酸反应生成二氧化硫、二氧化碳与水,反应方程式为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;反应生成二氧化硫,二氧化硫具有漂白性,B装置中品红溶液褪色;
反应中体现浓硫酸的强氧化性;
由装置可知,实验是通过测定E装置碱石灰增重,测定二氧化碳的质量,进而测定铁的含量,碱石灰可以吸收二氧化硫,二氧化硫具有还原性,可以被酸性高锰酸钾氧化二除去,根据颜色变化确定二氧化硫是否除尽,故C的作用是除去二氧化硫并检验二氧化硫以除尽,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;品红溶液褪色;强氧化性;除去二氧化硫并检验二氧化硫以除尽;
(4)随反应进行浓硫酸变为稀硫酸,铁与稀硫酸反应生成硫酸亚铁与氢气,反应离子方程式为:Fe+2H+=Fe2+H2↑,
故答案为:Fe+2H+=Fe2+H2↑;
(5)碳铁合金在酸溶液中形成原电池,原电池能加快化学反应速率,故答案为:碳铁合金在酸溶液中形成原电池;
(6)称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量为
×12g/mol=
g,则含铁的质量为ag-
g,铁的质量分数为
=1-
,
E中所装试剂为碱石灰,可吸收空气中CO2、H2O使测定二氧化碳的质量增大,应则E装置后再连接1个装有碱石灰的干燥管,
故答案为:1-
;另一个装有碱石灰的干燥管.
故答案为:蒸馏烧瓶;常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应;
(3)加热条件下,Fe、碳都与浓硫酸反应,碳与浓硫酸反应生成二氧化硫、二氧化碳与水,反应方程式为:C+2H2SO4(浓)
| ||
反应中体现浓硫酸的强氧化性;
由装置可知,实验是通过测定E装置碱石灰增重,测定二氧化碳的质量,进而测定铁的含量,碱石灰可以吸收二氧化硫,二氧化硫具有还原性,可以被酸性高锰酸钾氧化二除去,根据颜色变化确定二氧化硫是否除尽,故C的作用是除去二氧化硫并检验二氧化硫以除尽,
故答案为:C+2H2SO4(浓)
| ||
(4)随反应进行浓硫酸变为稀硫酸,铁与稀硫酸反应生成硫酸亚铁与氢气,反应离子方程式为:Fe+2H+=Fe2+H2↑,
故答案为:Fe+2H+=Fe2+H2↑;
(5)碳铁合金在酸溶液中形成原电池,原电池能加快化学反应速率,故答案为:碳铁合金在酸溶液中形成原电池;
(6)称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下E装置并称重,E增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量为
| bg |
| 44g/mol |
| 3b |
| 11 |
| 3b |
| 11 |
ag-
| ||
| ag |
| 3b |
| 11a |
E中所装试剂为碱石灰,可吸收空气中CO2、H2O使测定二氧化碳的质量增大,应则E装置后再连接1个装有碱石灰的干燥管,
故答案为:1-
| 3b |
| 11a |
点评:本题考查物质组成含量测定、浓硫酸的性质及实验,熟悉装置及装置中每部分的作用是解答本题的关键,难度适中.

练习册系列答案
相关题目

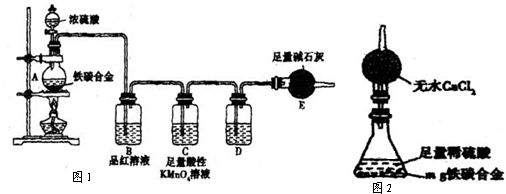
 (5)经过大家的讨论,决定采用下图装置(干燥管中试剂为无水氯化钙,锥形瓶中为mg铁炭合金和足量稀硫酸.)和其他常用实验仪器测定某些数据即可.为了快速测算出铁的质量分数,最简便的实验操作是
(5)经过大家的讨论,决定采用下图装置(干燥管中试剂为无水氯化钙,锥形瓶中为mg铁炭合金和足量稀硫酸.)和其他常用实验仪器测定某些数据即可.为了快速测算出铁的质量分数,最简便的实验操作是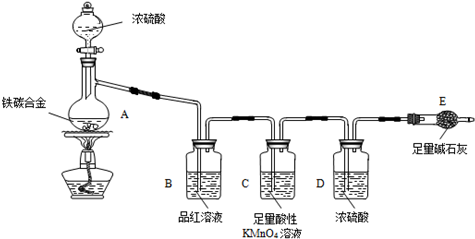
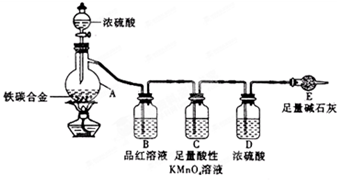
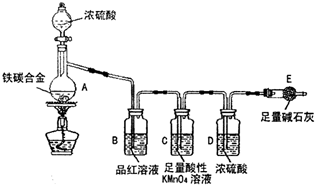 某化学兴趣小组为了测定某铁碳合金(看成铁和碳两种单质的混合物)中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的装置(夹持仪器已省略)和方案进行实验.
某化学兴趣小组为了测定某铁碳合金(看成铁和碳两种单质的混合物)中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的装置(夹持仪器已省略)和方案进行实验.