摘要:15.取2.160g只含一种官能团的某芳香族化合物置于5.000 L氧气中点燃完全燃烧.室温下.测得反应后气体体积减少0.672L.将反应后的气体缓缓通过足量的固体Na2O2后.固体质量增加3.920g.试通过计算说明能否确定该有机物的分子式.若能.试写出其结构简式,若不能.请说明理由.(题中所有数据均已换算为标准状况下)
网址:http://m.1010jiajiao.com/timu3_id_369768[举报]
(2012?唐山二模)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
(1)已知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489kJ?mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
则a=
(2)在T℃时,该反应的平衡常数K=64,在体积均为2L的恒容密闭容器甲和乙中,分别按下所示加入物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为
②下列说法正确的是
a.增加Fe2O3的量可以提高CO的转化率
b.甲、乙容器中CO的平衡转化率之比大于1
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.若容器内气体密度恒定时,标志反应达到平衡状态
(3)实验室有提纯后的铁矿粉(含氧化铁、氧化亚铁中的一种或两种),请设计实验探究其成分:
实验室仅提供如下仪器和试剂:烧杯、试管、玻璃棒、药匙、胶头滴管、酒精灯、试管夹;3mol/L H2SO4溶液、0.01mol/L KMnO4溶液、20% KSCN溶液、蒸馏水.
①提出合理假设:
假设1:只含氧化亚铁;
假设2:只含氧化铁;
假设3:
②请在下列表格中填写实验步骤、预期现象与结论.(可不必填满)
查看习题详情和答案>>
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
(1)已知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489kJ?mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
则a=
-28.5
-28.5
kJ?mol-1,炼铁反应平衡常数K随温度升高而减小
减小
(填“增大”、“不变”或“减小”).(2)在T℃时,该反应的平衡常数K=64,在体积均为2L的恒容密闭容器甲和乙中,分别按下所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲 | 1.0mol | 1.0mol | 1.0mol | 1.0mol |
| 乙 | 1.0mol | 2.0mol | 1.0mol | 1.0mol |
60%
60%
.②下列说法正确的是
cd
cd
(填字母).a.增加Fe2O3的量可以提高CO的转化率
b.甲、乙容器中CO的平衡转化率之比大于1
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.若容器内气体密度恒定时,标志反应达到平衡状态
(3)实验室有提纯后的铁矿粉(含氧化铁、氧化亚铁中的一种或两种),请设计实验探究其成分:
实验室仅提供如下仪器和试剂:烧杯、试管、玻璃棒、药匙、胶头滴管、酒精灯、试管夹;3mol/L H2SO4溶液、0.01mol/L KMnO4溶液、20% KSCN溶液、蒸馏水.
①提出合理假设:
假设1:只含氧化亚铁;
假设2:只含氧化铁;
假设3:
既含氧化亚铁又含氧化铁
既含氧化亚铁又含氧化铁
.②请在下列表格中填写实验步骤、预期现象与结论.(可不必填满)
| 实验操作 | 预期现象及结论 |
| 步骤1:取少量样品于烧杯中加适量稀硫酸溶解 | \ |
| 步骤2: 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 |
若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 |
| 步骤3: 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 |
若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 |
| 步骤4: 空 空 |
空 空 |
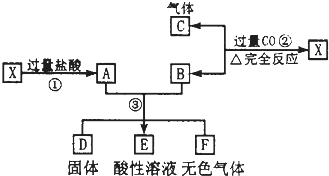 已知X为FeO和CuO的混合物,取两份等质量的X样品进行了①、②、③步实验,关系如图(其中固体D不溶于稀盐酸):
已知X为FeO和CuO的混合物,取两份等质量的X样品进行了①、②、③步实验,关系如图(其中固体D不溶于稀盐酸):(1)写出物质D的化学式:
(2)若所得固体D的质量为32g,溶液E中只含一种金属离子,气体F在标准状况下体积为5.6L,试计算X中FeO与CuO的质量比(写出计算过程).
CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物.通过下述实验确定该晶体的组成.
步骤a:称取0.6720g样品,放入锥形瓶,加入适量2mol?L-1稀硫酸,微热使样品溶解.再加入30ml水加热,用0.2000mol?L-1 KMnO4溶液滴定至终点,消耗8.00ml.
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色.冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI.用0.2500mol?L-1 Na2S2O3标准溶液滴定至终点,消耗8.00ml.
已知涉及的部分离子方程式为:
步骤a:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6mol?L-1,应保持溶液中c(I-)≥
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+.
该反应的离子方程式为
若无该操作,则测定的Cu2+的含量将会
(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为
(4)通过计算确定样品晶体的组成.
查看习题详情和答案>>
步骤a:称取0.6720g样品,放入锥形瓶,加入适量2mol?L-1稀硫酸,微热使样品溶解.再加入30ml水加热,用0.2000mol?L-1 KMnO4溶液滴定至终点,消耗8.00ml.
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色.冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI.用0.2500mol?L-1 Na2S2O3标准溶液滴定至终点,消耗8.00ml.
已知涉及的部分离子方程式为:
步骤a:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6mol?L-1,应保持溶液中c(I-)≥
1.27×10-6
1.27×10-6
mol?L-1.(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+.
该反应的离子方程式为
4MnO4-+12H+
4Mn2++5O2↑+6H2O
| ||
4MnO4-+12H+
4Mn2++5O2↑+6H2O
.
| ||
若无该操作,则测定的Cu2+的含量将会
偏高
偏高
(填“偏高”、“偏低”或“不变”).(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为
溶液由蓝色变为无色,且半分钟内不变色
溶液由蓝色变为无色,且半分钟内不变色
.(4)通过计算确定样品晶体的组成.
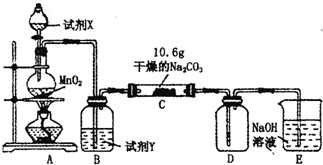 某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反得到固体物质的成分.
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反得到固体物质的成分.(1)A中制取Cl2的离子方程式
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究.
①提出合理假设.
假设1:存在两种成分:NaHCO3和
假设2:存在三种成分:NaHCO3和
②设计方案,进行实验.写出实验步骤以及预期现象和结论.
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. |
|
| 步骤2:向A试管中滴加适量BaCl2溶液. | |
| 步骤3: |
 物质的转化关系如图所示,其中甲可由两种单质直接化合得到,乙为金属单质,
物质的转化关系如图所示,其中甲可由两种单质直接化合得到,乙为金属单质,F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化.若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性.则
(1)①反应的化学方程式是
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(2)②③两步反应的离子方程式分别是
2Na2O2+2H2O═4Na++4OH-+O2↑
2Na2O2+2H2O═4Na++4OH-+O2↑
,2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑
2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑
.(3)在④的反应中,每1molE参加反应,将会有
| 2 |
| 3 |
| 2 |
| 3 |