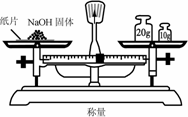
摘要:18.钠和氯气反应可以在下面的试验装置中完成.将新切取并用滤纸吸去煤油的一小块钠.放入具支试管中.然后按照图组装好. 加热金属钠.到钠熔化成光亮的球状时.立即 通入氯气.并停止加热.此时可看到钠剧烈燃 烧并生成大量白烟.片刻.试管内壁各处都附 着一层白色固体.请完成下面问题: ⑴停止加热.反应仍能继续进行.说明该反应是 反应. ⑵有时熔融的钠跟氯气接触时会产生黑烟.这是因为 . ⑶具支试管的支管应通到10%的NaOH溶液中.防止 . ⑷钠刚熔化时就要通入氯气.如果熔化前通氯气或熔化后还不通氯气都会影响实验效果.为什么 . ⑸通入氯气的量不要太多以免 但也不能太少.以免 . (6)有同学想证明白色固体就是NaCl.应补充什么实验来说明 .
网址:http://m.1010jiajiao.com/timu3_id_368732[举报]
| |||||||||||||||||||||||||||
钠和氯是我们熟悉的典型金属元素与非金属元素,研究它们的性质对于生产、生活、科研具有重要意义.请回答以下问题:
(1)金属钠在空气中燃烧的产物,常用于呼吸面具中的供氧剂,其工作原理是(用化学反应方程式回答)
(2)某化学兴趣小组设计以下装置来验证Cl2的性质.
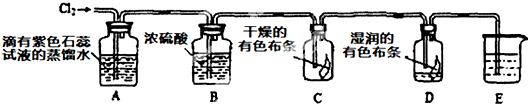
①装置A中的现象是
②装置B的作用是
③装置C与装置D中的现象是否相同
④装置E的作用是吸收尾气,盛放的试剂最好是
查看习题详情和答案>>
(1)金属钠在空气中燃烧的产物,常用于呼吸面具中的供氧剂,其工作原理是(用化学反应方程式回答)
2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑
.(2)某化学兴趣小组设计以下装置来验证Cl2的性质.

①装置A中的现象是
溶液先变红后褪色
溶液先变红后褪色
,发生反应的离子方程式为Cl2+H2O=H++Cl-+HClO
Cl2+H2O=H++Cl-+HClO
,上述反应中若有336mL(标准状况)Cl2参加反应,参加反应的还原剂的物质的量为0.0075mol
0.0075mol
.②装置B的作用是
干燥氯气
干燥氯气
.③装置C与装置D中的现象是否相同
否
否
(填“是”或“否”),根据装置C和D中的现象可以得到的结论是干燥的氯气没有漂白性
干燥的氯气没有漂白性
.④装置E的作用是吸收尾气,盛放的试剂最好是
氢氧化钠溶液
氢氧化钠溶液
.钠和氯是我们熟悉的典型金属元素与非金属元素,研究它们的性质对于生产、生活、科研具有重要意义.请回答以下问题:
(1)金属钠在空气中燃烧的产物,常用于呼吸面具中的供氧剂,其工作原理是(用化学反应方程式回答)______.
(2)某化学兴趣小组设计以下装置来验证Cl2的性质.
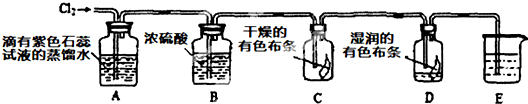
①装置A中的现象是______,发生反应的离子方程式为______,上述反应中若有336mL(标准状况)Cl2参加反应,参加反应的还原剂的物质的量为______.
②装置B的作用是______.
③装置C与装置D中的现象是否相同______(填“是”或“否”),根据装置C和D中的现象可以得到的结论是______.
④装置E的作用是吸收尾气,盛放的试剂最好是______.
查看习题详情和答案>>
钠和氯是我们熟悉的典型金属元素与非金属元素,研究它们的性质对于生产、生活、科研具有重要意义.请回答以下问题:
(1)金属钠在空气中燃烧的产物,常用于呼吸面具中的供氧剂,其工作原理是(用化学反应方程式回答)______.
(2)某化学兴趣小组设计以下装置来验证Cl2的性质.
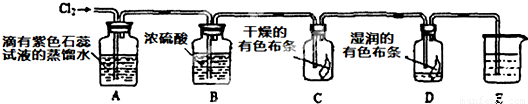
①装置A中的现象是______,发生反应的离子方程式为______,上述反应中若有336mL(标准状况)Cl2参加反应,参加反应的还原剂的物质的量为______.
②装置B的作用是______.
③装置C与装置D中的现象是否相同______(填“是”或“否”),根据装置C和D中的现象可以得到的结论是______.
④装置E的作用是吸收尾气,盛放的试剂最好是______.
查看习题详情和答案>>
(1)金属钠在空气中燃烧的产物,常用于呼吸面具中的供氧剂,其工作原理是(用化学反应方程式回答)______.
(2)某化学兴趣小组设计以下装置来验证Cl2的性质.

①装置A中的现象是______,发生反应的离子方程式为______,上述反应中若有336mL(标准状况)Cl2参加反应,参加反应的还原剂的物质的量为______.
②装置B的作用是______.
③装置C与装置D中的现象是否相同______(填“是”或“否”),根据装置C和D中的现象可以得到的结论是______.
④装置E的作用是吸收尾气,盛放的试剂最好是______.
查看习题详情和答案>>
下表是实验室制备气体的有关内容:
(1)上述气体制备中,从反应中有无电子转移的角度看,明显不同于其他气体的是
(2)若用上述制备O2的装置制备NH3,应选择的试剂为
(3)在浓CaCl2溶液中通入NH3和CO2可以制得纳米级碳酸钙,制取时应先通入的气体是
(4)制备Cl2需用8mol?L-1的盐酸100ml,现用12mol?L-1的盐酸来配制.
①需要用量筒量取12mol?L-1的盐酸的体积为
②下列实验操作中,不正确的是
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次.
查看习题详情和答案>>
| 编号 | 实验内容 | 实验原理 |
| ① | 制氧气 | H2O2→O2 |
| ② | 制氨气 | NH4Cl→NH3 |
| ③ | 制氯气 | HCl→Cl2 |
②
②
(填编号),其实验室制取该气体的化学方程式Ca(OH)2+2NH4Cl
CaCl2+2NH3+2H2O
| ||
Ca(OH)2+2NH4Cl
CaCl2+2NH3+2H2O
.
| ||
(2)若用上述制备O2的装置制备NH3,应选择的试剂为
浓氨水和氢氧化钠(或生石灰或碱石灰)
浓氨水和氢氧化钠(或生石灰或碱石灰)
.(3)在浓CaCl2溶液中通入NH3和CO2可以制得纳米级碳酸钙,制取时应先通入的气体是
NH3
NH3
,试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级取少量样品和水混合形成分散系,用一束光从侧面照射,若出现光亮的通路,则证明样品是纳米级,否则不是
取少量样品和水混合形成分散系,用一束光从侧面照射,若出现光亮的通路,则证明样品是纳米级,否则不是
. (4)制备Cl2需用8mol?L-1的盐酸100ml,现用12mol?L-1的盐酸来配制.
①需要用量筒量取12mol?L-1的盐酸的体积为
66.7
66.7
mL;②下列实验操作中,不正确的是
BC
BC
.A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加入蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次.