摘要:逆反应方向①⑤
网址:http://m.1010jiajiao.com/timu3_id_368713[举报]
(一)恒温恒容下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)?x C(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol?L-1.
(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)A的转化率与B的转化率之比为
(4)下列各项可作为该反应达到平衡状态的标志的是
A.压强不再变化 B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2:1
(二)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
①根据表中数据可判断△H
②在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1451.6kJ?mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4KOH═2K2CO3+6H2O,则正极的电极反应式为
(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为
查看习题详情和答案>>
(1)从开始反应至达到平衡状态,生成C的平均反应速率为
0.6mol/(L?min)
0.6mol/(L?min)
.(2)x=
3
3
.(3)A的转化率与B的转化率之比为
2:1
2:1
.(4)下列各项可作为该反应达到平衡状态的标志的是
B
B
.A.压强不再变化 B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2:1
(二)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
<
<
0 (填“>”、“=”或“<”).②在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将
A
A
.A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1451.6kJ?mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1
写出该条件下甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ/mol
CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ/mol
.(3)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4KOH═2K2CO3+6H2O,则正极的电极反应式为
O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
,随着反应的不断进行溶液的pH减小
减小
(填“增大”“减小”或“不变”).(4)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
.(1)一定温度下,向1L 0.1mol?L-1 CH3COOH溶液中加入0.1mol CH3COONa固体,则醋酸的电离平衡向
的值
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3?H2O.已知:
a.常温下,醋酸和NH3?H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O.
则CH3COONH4溶液呈
(3)99℃时,Kw=1.0×10-12,该温度下测得0.1mol?L-1 Na2A溶液的pH=6.
①H2A在水溶液中的电离方程式为
②该温度下,将0.01mol?L-1 H2A溶液稀释到20倍后,溶液的pH=
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气
A.盐酸多 B.H2A多
C.一样多 D.无法确定
④将0.1mol?L-1 H2A溶液与0.2mol?L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为
查看习题详情和答案>>
逆
逆
(填“正”或“逆”)反应方向移动;溶液中| c(CH3COO-)?c(H+) | c(CH3COOH) |
不变
不变
(填“增大”、“减小”或“不变”).(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3?H2O.已知:
a.常温下,醋酸和NH3?H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O.
则CH3COONH4溶液呈
中
中
性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈碱
碱
性,NH4HCO3溶液中物质的量浓度最大的离子是NH4+
NH4+
(填化学式).(3)99℃时,Kw=1.0×10-12,该温度下测得0.1mol?L-1 Na2A溶液的pH=6.
①H2A在水溶液中的电离方程式为
H2A═2H++A2-
H2A═2H++A2-
.②该温度下,将0.01mol?L-1 H2A溶液稀释到20倍后,溶液的pH=
3
3
.③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气
C
C
.A.盐酸多 B.H2A多
C.一样多 D.无法确定
④将0.1mol?L-1 H2A溶液与0.2mol?L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为
c(NH4+)>c(A2-)>c(H+)>c(OH-)
c(NH4+)>c(A2-)>c(H+)>c(OH-)
.
CO2可转化成有机物实现碳循环.
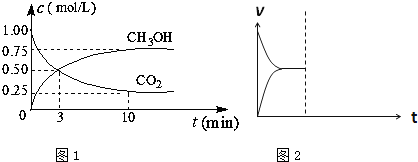
(1)在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol?L-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从0min到10min,v(H2)= mol?(L?min)-1.
②能说明上述反应达到平衡状态的是 (选填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号).
A.将H2O(g)从体系中分离B.恒温恒容充入He
C.恒温恒压充入He D.恒温恒容再充入1mol CO2和3mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实.2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)在一定压强下,测得反应的实验数据如下表.
分析表中数据回答下列问题:
①反应的温度升高,K值 (填“增大”、“减小”或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值 (填“增大”、“减小”或“不变”).
(3)800℃时,C(s)+CO2(g)?2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20mol?L-1、c(CO2)=0.05mol?L-1,此时反应向 (填“正”或“逆”)方向进行.
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)?CO(g)+H2O(g)△H>0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在图2中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图. 查看习题详情和答案>>

(1)在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0mol?L-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从0min到10min,v(H2)=
②能说明上述反应达到平衡状态的是
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是
A.将H2O(g)从体系中分离B.恒温恒容充入He
C.恒温恒压充入He D.恒温恒容再充入1mol CO2和3mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实.2CO2(g)+6H2(g)
| 催化剂 |
| 温度/k CO2转化率% |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
①反应的温度升高,K值
②提高氢碳比[n(H2)/n(CO2)],K值
(3)800℃时,C(s)+CO2(g)?2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20mol?L-1、c(CO2)=0.05mol?L-1,此时反应向
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)?CO(g)+H2O(g)△H>0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在图2中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图. 查看习题详情和答案>>
(1)25℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取lmolN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是______92.4kJ.(填“小于”,“大于”或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是______.
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
v正(NH3)=v逆(H2)
C.容器内的密度不再变化
D.单位时间内消耗amolN2,同时生成2amolNH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为______.向此溶液中加入少量的氯化铵固体,此时
值将______(填“增大”,“减小”或“不变”).
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=______时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
查看习题详情和答案>>
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取lmolN2和3molH2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是______92.4kJ.(填“小于”,“大于”或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是______.
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
| 2 |
| 3 |
C.容器内的密度不再变化
D.单位时间内消耗amolN2,同时生成2amolNH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为______.向此溶液中加入少量的氯化铵固体,此时
c(N
| ||
| c(OH-) |
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=______时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
(1)25℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取l mol N2和3mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是 92.4kJ.(填“小于”,“大于”或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是 .
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
v正(NH3)=v逆(H2)
C.容器内的密度不再变化
D.单位时间内消耗a mol N2,同时生成2a mol NH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为 .向此溶液中加入少量的氯化铵固体,此时
值将 (填“增大”,“减小”或“不变”).
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH= 时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
查看习题详情和答案>>
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
①在该温度时,取l mol N2和3mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是
A.NH3生成的速率与NH3分解的速率相等
B.混合气体的反应速率
| 2 |
| 3 |
C.容器内的密度不再变化
D.单位时间内消耗a mol N2,同时生成2a mol NH3
(2)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得PH=11,则该条件下,NH3?H2O的电离平衡常数为
c(N
| ||
| c(OH-) |
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=