摘要:22.请从下列a-g仪器中选择适当的仪器填空. (1) 开始时液面在a mL处.继续添加液体至液面在b mL处.则所加液体体积为(a-b)mL的是 . (2) 仪器上标明了使用温度的是 . (3) 用8.2 mL的浓盐酸配制一定物质的量浓度的稀盐酸.不可缺少的仪器是 .
网址:http://m.1010jiajiao.com/timu3_id_368692[举报]
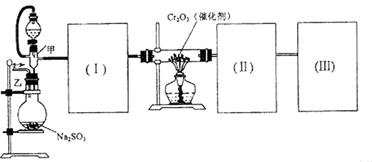
(15分)用下图装置进行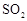 转化为
转化为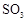 的转化率测定实验:
的转化率测定实验: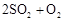
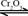
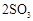 ;
;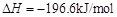 。已知:
。已知:
| | 熔点(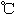 ) ) | 沸点(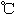 ) ) |
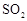 | -72.4 | -10 |
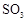 | 16.8 | 44.3 |

(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接合适的装置(可重复使用),请从下列A~E中选择适宜的装置,将其序号填入空格内。
(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程) 。
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起的作用是 。
(4)开始实验时,先从乙处均匀通入
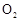 ,为使
,为使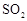 有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。
有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是 。(5)实验中“当
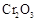 表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是 ;若用大火加热有
表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是 ;若用大火加热有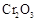 处的反应管时,
处的反应管时,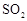 的转化率会 (填“升高”、“降低”或“不变”)。
的转化率会 (填“升高”、“降低”或“不变”)。(6)实验时若用25.2g的
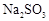 ,加入的浓硫酸是足量的,反应结束时继续通入
,加入的浓硫酸是足量的,反应结束时继续通入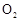 一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中
一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中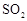 的转化率为 %(保留小数点后一位)。
查看习题详情和答案>>
的转化率为 %(保留小数点后一位)。
查看习题详情和答案>>
(15分)用下图装置进行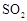 转化为
转化为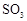 的转化率测定实验:
的转化率测定实验:

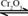
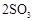 ;
;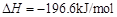 。已知:
。已知:
|
|
熔点( |
沸点( |
|
|
-72.4 |
-10 |
|
|
16.8 |
44.3 |
(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接合适的装置(可重复使用),请从下列A~E中选择适宜的装置,将其序号填入空格内。

(2)将装置连接好,实验前,必须进行的操作是(不必写具体过程) 。
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起的作用是 。
(4)开始实验时,先从乙处均匀通入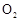 ,为使
,为使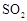 有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是
。
有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是
。
(5)实验中“当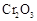 表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是
;若用大火加热有
表面红热时,应将酒精灯移开一会儿再加热”,以防温度过高,这样做的原因是
;若用大火加热有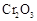 处的反应管时,
处的反应管时,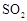 的转化率会
(填“升高”、“降低”或“不变”)。
的转化率会
(填“升高”、“降低”或“不变”)。
(6)实验时若用25.2g的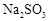 ,加入的浓硫酸是足量的,反应结束时继续通入
,加入的浓硫酸是足量的,反应结束时继续通入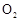 一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中
一段时间,称得Ⅱ处装置的质量增加11.3g,则本实验中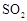 的转化率为
%(保留小数点后一位)。
的转化率为
%(保留小数点后一位)。
查看习题详情和答案>>
(2013?泰安三模)钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料.以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti.工业流程如图1所示:

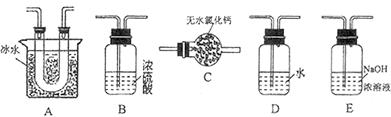
(1)粗TiC14中含有少量FeCl3、SiCl4等,它们的部分性质如下:
从粗TiC14中精制TiC14的方法是
(2)写出用惰性电极电解熔融NaCl时阳极的电极反应式:
(3)Ti可溶解在浓HF溶液中,请完成下列离子方程式:
+
(4)如图2所示是一个制取氯气并以氯气为原料进行反应的装置.
①装置A中发生反应的化学方程式为
②在实验室中,某同学欲用如图3所示装置净化氯气,则M、N中应盛放的试剂分别是
③实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃C处酒精灯.Cl2通过装置M、N再进入装置C,与装置C中的固体粉末发生氧化还原反应生成CO气体.试写出装置C中发生反应的化学方程式:
查看习题详情和答案>>

(1)粗TiC14中含有少量FeCl3、SiCl4等,它们的部分性质如下:
| 物质 | 沸点/℃ | 在水中 | 在乙醚中 |
| TiC14 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
B
B
(填字母).A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液(2)写出用惰性电极电解熔融NaCl时阳极的电极反应式:
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
;阴极产物是钠
钠
.(3)Ti可溶解在浓HF溶液中,请完成下列离子方程式:
1
1
Ti+6
6
HF═1
1
Ti| F | 2- 6 |
2
2
H+
H+
+2
2
H2↑(4)如图2所示是一个制取氯气并以氯气为原料进行反应的装置.
①装置A中发生反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
②在实验室中,某同学欲用如图3所示装置净化氯气,则M、N中应盛放的试剂分别是
饱和食盐水
饱和食盐水
、浓硫酸
浓硫酸
.(填试剂名称)③实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃C处酒精灯.Cl2通过装置M、N再进入装置C,与装置C中的固体粉末发生氧化还原反应生成CO气体.试写出装置C中发生反应的化学方程式:
TiO2+2Cl2+2C
TiCl4+2CO
| ||
TiO2+2Cl2+2C
TiCl4+2CO
.
| ||
海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在.有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
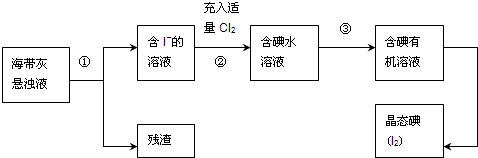
(1)灼烧海带时需要用到的实验仪器是
A.烧杯 B.坩锅 C.表面皿 D.铁架台(带铁圈) E.酒精灯 F.干燥器
(2)指出提取碘的过程中有关的实验操作名称:①
(3)过程②中充入适量Cl2的目的是
(4)操作③中所用的有机试剂可以是
(5)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层.
a.上述G步操作的目的是:
b.最后碘的有机溶液是通过
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
(7)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置指出其错误之处并加以改正
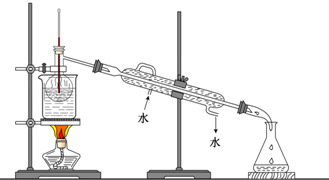
(8)进行上述蒸馏操作时,使用水浴的原因是
查看习题详情和答案>>

(1)灼烧海带时需要用到的实验仪器是
BDE
BDE
(从下列仪器中选出所需的仪器,用标号字母填写在空白处).A.烧杯 B.坩锅 C.表面皿 D.铁架台(带铁圈) E.酒精灯 F.干燥器
(2)指出提取碘的过程中有关的实验操作名称:①
过滤
过滤
,③萃取
萃取
;(3)过程②中充入适量Cl2的目的是
使I-转化为I2
使I-转化为I2
;(4)操作③中所用的有机试剂可以是
四氯化碳
四氯化碳
(只填一种),简述选择其理由不溶于水且溶解碘的能力远大于水
不溶于水且溶解碘的能力远大于水
.(5)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层.
a.上述G步操作的目的是:
平衡压力便于液体流出
平衡压力便于液体流出
;b.最后碘的有机溶液是通过
漏斗下口
漏斗下口
获得(填“漏斗上口”或“漏斗下口”).(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
取提取碘后的水溶液于试管中,加入淀粉溶液,不变蓝,说明没有I2剩余
取提取碘后的水溶液于试管中,加入淀粉溶液,不变蓝,说明没有I2剩余
.(7)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置指出其错误之处并加以改正
温度计应该插到支管口略靠下位置,冷却水方向应该是下进上出
温度计应该插到支管口略靠下位置,冷却水方向应该是下进上出
;?
(8)进行上述蒸馏操作时,使用水浴的原因是
控制温度,使蒸馏烧瓶内液体受热均匀,防止碘升华
控制温度,使蒸馏烧瓶内液体受热均匀,防止碘升华
,最后晶态碘在蒸馏烧瓶
蒸馏烧瓶
里聚集. 二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象.为了避免产生沉淀,某化学小组设计了如下实验装置,实验操作步骤如下:
二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象.为了避免产生沉淀,某化学小组设计了如下实验装置,实验操作步骤如下:①气密性检查完好后,在装置A中的多孔隔板上放上锌粒,通过
长颈漏斗
长颈漏斗
注入稀硫酸.打开活塞,将产生的氢气导入到后续装置.②
D中气泡均匀冒出后
D中气泡均匀冒出后
后关闭活塞,将装置D的导管插入烧杯中.③通过装置B的
分液漏斗
分液漏斗
滴加浓硫酸,产生的气体进入到BaCl2溶液中,溶液保持澄清.④打开活塞,将产生的氢气导入后续装置一段时间.
⑤将盛有BaCl2溶液的试管从装置中取出,拔去橡皮塞用胶头滴管伸入到苯层下方滴加双氧水,随即出现白色浑浊,滴加稀盐酸并振荡,白色浑浊不消失.
⑥拆卸装置,清洗仪器,处理剩余药品.
请回答下列问题
(1)实验步骤①和③的空白处使用的仪器分别为
长颈漏斗
长颈漏斗
、分液漏斗
分液漏斗
;(2)装置C中苯的作用是
将BaCl2溶液与空气隔离
将BaCl2溶液与空气隔离
;(3)实验步骤②的操作为
将装置D的导管口向上,用试管收集氢气验纯,待氢气纯净
将装置D的导管口向上,用试管收集氢气验纯,待氢气纯净
;(4)实验步骤④的目的是
除去SO2防止污染
除去SO2防止污染
;(5)写出实验步骤⑤试管中发生反应的化学方程式
SO2+H2O2=H2SO4、H2SO4+BaCl2=BaSO4↓+2HCl
SO2+H2O2=H2SO4、H2SO4+BaCl2=BaSO4↓+2HCl
;(6)为了避免产生沉淀,你认为还应采取哪些措施,请举一例
将BaCl2溶液煮沸
将BaCl2溶液煮沸
. )
)