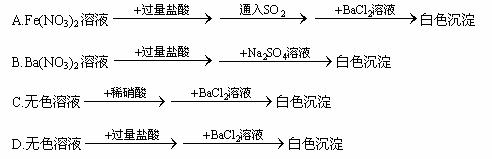
摘要:9.下列实验过程完成后.最终的白色沉淀不一定是BaSO4的是 A.Fe(NO3)2溶液 白色沉淀 B.Ba(NO3)2溶液 白色沉淀 C.无色溶液 白色沉淀 D.无色溶液无明显现象白色沉淀
网址:http://m.1010jiajiao.com/timu3_id_368634[举报]
|
下列实验过程完成后,最终的白色沉淀不一定是BaSO4的是 | |
| [ ] | |
A. |
Fe(NO3)2溶液 |
B. |
Ba(NO3)2溶液 |
C. |
无色溶液 |
D. |
无色溶液 |
摩尔盐[xFeSO4?y(NH4)2SO4?zH2O]是一种重要化工原料.其组成可通过下列实验测定:
①称取1.568 0g样品,准确配成100mL溶液A.
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.466 0g.
③再量取25.00mL溶液A,滴加适量稀硫酸,用0.020 0mol?L-1 KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00mL.
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(S
)≤1.0×10-5 mol?L-1,应保持溶液中c(Ba2+ )≥
(2)③中发生反应的离子方程式为
(3)通过计算确定样品的组成(必须写出计算过程).
查看习题详情和答案>>
①称取1.568 0g样品,准确配成100mL溶液A.
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.466 0g.
③再量取25.00mL溶液A,滴加适量稀硫酸,用0.020 0mol?L-1 KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00mL.
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(S
| O | 2- 4 |
1.1×10-5
1.1×10-5
mol?L-1.(2)③中发生反应的离子方程式为
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
,滴定终点的现象是滴入最后一滴KMnO4时,溶液由无色变为浅紫色,且半分钟内不变色
滴入最后一滴KMnO4时,溶液由无色变为浅紫色,且半分钟内不变色
.(3)通过计算确定样品的组成(必须写出计算过程).
(1)某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
a取少量待测液,仔细观察,呈无色;
b向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.
据此可以判断该待测液中一定含有的阳离子是
(2)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色.某同学在探究铁的化合物的相互转化时,进行了如下实验.请你参与讨论.
实验操作:向20mL的FeSO4溶液中,滴加浓溴水,振荡.
实验现象:溶液由浅绿色(近乎无色)变成黄色.
a溶液颜色发生改变的原因可能是
①使溶液呈黄色的微粒是Br2
②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
b为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
①方案1的结论是否合理
②方案2的结论明显不合理,可能发生反应的离子方程式为
③方案3的结论也不合理,理由是
④你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):
查看习题详情和答案>>
a取少量待测液,仔细观察,呈无色;
b向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.
据此可以判断该待测液中一定含有的阳离子是
Al3+、NH4+
Al3+、NH4+
,一定没有的阳离子是Fe3+
Fe3+
.还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称)焰色反应
焰色反应
,现象是透过蓝色钴玻璃呈紫色
透过蓝色钴玻璃呈紫色
.(2)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色.某同学在探究铁的化合物的相互转化时,进行了如下实验.请你参与讨论.
实验操作:向20mL的FeSO4溶液中,滴加浓溴水,振荡.
实验现象:溶液由浅绿色(近乎无色)变成黄色.
a溶液颜色发生改变的原因可能是
①②③
①②③
(用选项符号表示).①使溶液呈黄色的微粒是Br2
②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
b为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
| 操作 | 实验现象及结论 | |
| 方案1 | 取少量黄色溶液,加入NaOH | 最终生成红褐色沉淀,说明溴水和FeSO4溶液发生了化学反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 溶液变蓝色,说明未发生化学反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 下层溶液呈橙红色,说明未发生化学反应 |
不合理
不合理
(填“合理”或“不合理”).②方案2的结论明显不合理,可能发生反应的离子方程式为
Br2+2I-=I2+2Br-
Br2+2I-=I2+2Br-
.③方案3的结论也不合理,理由是
溴水可能过量
溴水可能过量
.④你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):
取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+
取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+
.(1)某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
a取少量待测液,仔细观察,呈无色;
b向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.
据此可以判断该待测液中一定含有的阳离子是______,一定没有的阳离子是______.还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称)______,现象是______.
(2)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色.某同学在探究铁的化合物的相互转化时,进行了如下实验.请你参与讨论.
实验操作:向20mL的FeSO4溶液中,滴加浓溴水,振荡.
实验现象:溶液由浅绿色(近乎无色)变成黄色.
a溶液颜色发生改变的原因可能是______(用选项符号表示).
①使溶液呈黄色的微粒是Br2
②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
b为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
| 操作 | 实验现象及结论 | |
| 方案1 | 取少量黄色溶液,加入NaOH | 最终生成红褐色沉淀,说明溴水和FeSO4溶液发生了化学反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 溶液变蓝色,说明未发生化学反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 下层溶液呈橙红色,说明未发生化学反应 |
②方案2的结论明显不合理,可能发生反应的离子方程式为______.
③方案3的结论也不合理,理由是______.
④你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):______. 查看习题详情和答案>>