摘要:18] A
网址:http://m.1010jiajiao.com/timu3_id_36858[举报]
 A.已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的
A.已知A、B、C、D、E是短周期中的五种元素,它们的原子序数依次增大.A和B可形成常见化合物BA4,一个BA4分子中电子总数为10;C原子的最外层电子数是核外电子总数的| 3 |
| 4 |
(1)D与E两元素相比较,非金属性较强的是
氯
氯
(填元素名称),请你自选试剂设计实验验证该结论(说明试剂、简单操作、实验现象)将Cl2通入Na2S溶液(或氢硫酸)中,有浅黄色沉淀生成,说明Cl的非金属性比S强
将Cl2通入Na2S溶液(或氢硫酸)中,有浅黄色沉淀生成,说明Cl的非金属性比S强
;(2)A、C、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有l0个电子,则甲与乙反应的离子方程式为
HS-+OH-═S2-+H2O
HS-+OH-═S2-+H2O
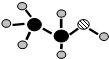
;(3)由A、B、C三种元素组成的化合物的球棍结构如图:,试写出利用植物秸秆生产这种物质的化学方程式
(C6H10O5)n+nH2O
nC6H12O6
| 催化剂 |
| △ |
(C6H10O5)n+nH2O
nC6H12O6
、| 催化剂 |
| △ |
C6H12O6
2CH3CH2OH+2CO2↑
| 一定条件 |
C6H12O6
2CH3CH2OH+2CO2↑
.| 一定条件 |
A、B、C、D、E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同,A与E形成的化合物化学式为AE,其分子中含18个电子,请回答下列问题:
(1)D元素的原子结构示意图为
 .
.
(2)由A、B、C三种元素形成的化合物的电子式为
 ,这种化合物形成的晶体中所含的化学键类型有
,这种化合物形成的晶体中所含的化学键类型有
(3)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是
查看习题详情和答案>>
(1)D元素的原子结构示意图为


(2)由A、B、C三种元素形成的化合物的电子式为


离子键、共价键
离子键、共价键
.(3)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是
ClO-+H2O HClO+OH-
HClO+OH-
 HClO+OH-
HClO+OH-ClO-+H2O HClO+OH-
HClO+OH-
(用离子方程式表示). HClO+OH-
HClO+OH-A、B、C、D为原子序数小于18的四种元素:
①A的原子的电子层数等于最外层电子数;
②A与B处于同一周期,B与D可形成离子化合物D2B,该化合物的水溶液显碱性;
③C的离子核内质子数与核外电子数之和为18;
④A、C、D三种元素的离子具有相同的电子层排布.
推断A~D各为何种元素,并填空:
(1)A
(2)四种元素离子半径的大小顺序为
(3)用离子方程式表示D2B水溶液呈碱性的原因
查看习题详情和答案>>
①A的原子的电子层数等于最外层电子数;
②A与B处于同一周期,B与D可形成离子化合物D2B,该化合物的水溶液显碱性;
③C的离子核内质子数与核外电子数之和为18;
④A、C、D三种元素的离子具有相同的电子层排布.
推断A~D各为何种元素,并填空:
(1)A
Al
Al
;BS
S
;CO
O
;DNa
Na
.(2)四种元素离子半径的大小顺序为
r(S2-)>r(O2-)>r(Na+)>r(Al3+)
r(S2-)>r(O2-)>r(Na+)>r(Al3+)
.(3)用离子方程式表示D2B水溶液呈碱性的原因
S2-+H2O
HS-+OH-、HS-+H2O
H2S+OH-.
| 水解 |
| 水解 |
S2-+H2O
HS-+OH-、HS-+H2O
H2S+OH-.
.| 水解 |
| 水解 |