摘要:5].在反应aBrF3+bH2O = cHBrO3+dHBr+eHF+fO2中(a.b.c.d.e.f是各物质的化学计量数).若0.3mol H2O被氧化.则被水还原的BrF3的物质的量是 A.0.15mol B.0.2 mol C.0.3 mol D.0.4 mol
网址:http://m.1010jiajiao.com/timu3_id_36821[举报]
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);测得CO2和CH3OH(g)的浓度随时间变化如图1所示.该反应过程中的能量变化如图2所示.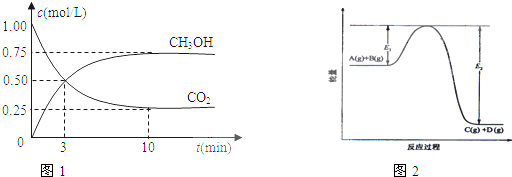
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=
(2)该反应的平衡常数表达式为
(3)如果在达平衡后某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡
a.向正反应方向移动 b.向逆反应方向移动 c.不移动 d.无法确定平衡移动方向
(4)下列措施中能使
增大的是
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(5)在反应体系中加入催化剂,E1和E2的变化是:E1
查看习题详情和答案>>

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=
0.225
0.225
mol/(L?min).(2)该反应的平衡常数表达式为
K=
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
K=
.该条件下的平衡常数K=| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
5.33
5.33
(可用分数表示),温度升高,K值减少
减少
(填“增大”“不变”或者“减少”)(3)如果在达平衡后某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡
b
b
(填写序号).a.向正反应方向移动 b.向逆反应方向移动 c.不移动 d.无法确定平衡移动方向
(4)下列措施中能使
| n(CH3OH) |
| n(CO2) |
CD
CD
.A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(5)在反应体系中加入催化剂,E1和E2的变化是:E1
减小
减小
,E2减小
减小
(填“增大”“减小、”“不变”).对反应热是否有影响?无
无
,原因是催化剂不能改变反应物的总能量与生成物总能量的差值,即反应热不变
催化剂不能改变反应物的总能量与生成物总能量的差值,即反应热不变
.(2009?沈阳三模)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下:

已知:①2KOH+Cl2→KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2→5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+2KClO+10KOH→2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)该生产工艺应在
(2)写出工业上制取Cl2的化学方程式
(3)K2FeO4具有强氧化性的原因
(4)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度为
(5)在“反应液I”中加KOH固体的目的是
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品
查看习题详情和答案>>

已知:①2KOH+Cl2→KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2→5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+2KClO+10KOH→2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)该生产工艺应在
温度较低
温度较低
(填“温度较高”或“温度较低”)情况下进行;(2)写出工业上制取Cl2的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
;
| ||
(3)K2FeO4具有强氧化性的原因
K2FeO4中铁元素化合价为+6价,易得电子
K2FeO4中铁元素化合价为+6价,易得电子
;(4)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度为
10mol/L
10mol/L
;(5)在“反应液I”中加KOH固体的目的是
AC
AC
:A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品
KNO3、KCl
KNO3、KCl
(写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途KNO3可用于化肥,炸药等
KNO3可用于化肥,炸药等
.实验室里用乙醇和浓硫酸反应生成乙烯,接着再用溴与之反应生成1,2-二溴乙烷.在制备过程中由于部分乙醇被浓硫酸氧化还会产生CO2、SO2,并进而与Br2反应生成HBr等酸性气体.
(1)以上述三种物质为原料,用下列仪器(短接口或橡皮管均已略去)制备1,2-二溴乙烷.

如果气体流向为从左到右,正确的连接顺序是:
(1)经A(1)B插入A中,D接A(2);A(3)接
(2)温度计水银球的正确位置是
(3)F的作用是
(4)在三颈烧瓶A中的主要反应的化学方程式为
(5)在反应管E中进行的主要反应的化学方程式为
(6)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为
查看习题详情和答案>>
(1)以上述三种物质为原料,用下列仪器(短接口或橡皮管均已略去)制备1,2-二溴乙烷.

如果气体流向为从左到右,正确的连接顺序是:
(1)经A(1)B插入A中,D接A(2);A(3)接
C
C
接F
F
接E
E
接G
G
.(2)温度计水银球的正确位置是
插入三颈烧瓶中的液体中
插入三颈烧瓶中的液体中
,若用分液漏斗代替D,可能会产生的问题是容器内压力过大时液体无法滴落
容器内压力过大时液体无法滴落
.(3)F的作用是
除去三颈瓶中产生的CO2、SO2
除去三颈瓶中产生的CO2、SO2
,G的作用是吸收挥发的溴蒸汽
吸收挥发的溴蒸汽
.(4)在三颈烧瓶A中的主要反应的化学方程式为
CH3CH2OH
CH2=CH2↑+H2O
| 浓H2SO4 |
| 170℃ |
CH3CH2OH
CH2=CH2↑+H2O
.| 浓H2SO4 |
| 170℃ |
(5)在反应管E中进行的主要反应的化学方程式为
CH2═CH2+Br2→BrCH2CH2Br
CH2═CH2+Br2→BrCH2CH2Br
.(6)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为
减少溴的挥发损失
减少溴的挥发损失
.(2012?保定一模)【化学一化学与技术】
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如图:
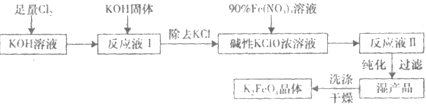
已知:
①温度较低时,Cl2通入KOH溶液生成次级酸盐;温度较高时,Cl2通入KOH溶液生成氯酸盐;
②Fe(NO3)3溶液与KClO溶液在强碱性环境中生成K2FeO4.请回答下列问题:
(1)该生产工艺应在
(2)为了提高生活用水的卫生标准,自来水厂常使用高铁酸钾(K2FeO4)进行消毒、净化以改善水质,其原因是
(3)经过高铁酸钾(K2FeO4)处理后的水不是纯净水,若要得到纯净水.可采用的净化方法是
(4)高铁酸钾溶于水形成浅紫红色溶液,溶液静置时会逐渐生成氧气并沉淀出三氧化二铁,此过程也会使溶液的pH增大.写出其化学方程式:
(5)在“反应液I”中加KOH固体的目的是为了①吸收“反应液I”中过量的Cl2,生成更多的KClO;②
(6)从“反应液Ⅱ”中分离出K2FeO4后,副产品是
查看习题详情和答案>>
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如图:

已知:
①温度较低时,Cl2通入KOH溶液生成次级酸盐;温度较高时,Cl2通入KOH溶液生成氯酸盐;
②Fe(NO3)3溶液与KClO溶液在强碱性环境中生成K2FeO4.请回答下列问题:
(1)该生产工艺应在
温度较低
温度较低
(填“温度较高”或“温度较低”)的情况下进行.(2)为了提高生活用水的卫生标准,自来水厂常使用高铁酸钾(K2FeO4)进行消毒、净化以改善水质,其原因是
+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒,还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉
+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒,还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉
(3)经过高铁酸钾(K2FeO4)处理后的水不是纯净水,若要得到纯净水.可采用的净化方法是
蒸馏
蒸馏
(4)高铁酸钾溶于水形成浅紫红色溶液,溶液静置时会逐渐生成氧气并沉淀出三氧化二铁,此过程也会使溶液的pH增大.写出其化学方程式:
4K2FeO4+4H2O=2Fe2O3+8KOH+3O2↑
4K2FeO4+4H2O=2Fe2O3+8KOH+3O2↑
(5)在“反应液I”中加KOH固体的目的是为了①吸收“反应液I”中过量的Cl2,生成更多的KClO;②
为下一步反应提供反应物
为下一步反应提供反应物
.(6)从“反应液Ⅱ”中分离出K2FeO4后,副产品是
KNO3
KNO3
和KCl
KCl
(写化学式).(2013?辽宁一模)[化学--选修2化学与技术]
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下:

已知:①2KOH+C12=KCl+KClO+H2O(条件:温度较低)
②6KOH+3C12=5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+2KClO+10KOH=2K2FeO4+6KNO3+2KCl+5H2O
回答下列问题:
(1)该生产工艺应在
(2)写出工业上制取C12的化学方程式
(3)K2FeO4可作为新型多功能水处理剂的原因
(4)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度是
(5)在“反应液I”中加KOH固体的目的是①
(6)从“反应液Ⅱ”中分离出K2FeO4后,副产品是
查看习题详情和答案>>
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下:

已知:①2KOH+C12=KCl+KClO+H2O(条件:温度较低)
②6KOH+3C12=5KCl+KClO3+3H2O(条件:温度较高)
③2Fe(NO3)3+2KClO+10KOH=2K2FeO4+6KNO3+2KCl+5H2O
回答下列问题:
(1)该生产工艺应在
温度较低
温度较低
(填“温度较高”或“温度较低”)的情况下进行;(2)写出工业上制取C12的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
;
| ||
(3)K2FeO4可作为新型多功能水处理剂的原因
+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉
+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉
;(4)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度是
10 mol/L
10 mol/L
;(5)在“反应液I”中加KOH固体的目的是①
与“反应液I”中过量的Cl2继续反应,生成更多的KClO
与“反应液I”中过量的Cl2继续反应,生成更多的KClO
②为下一步反应提供反应物
为下一步反应提供反应物
(6)从“反应液Ⅱ”中分离出K2FeO4后,副产品是
KNO3、KCl
KNO3、KCl
(写化学式).