网址:http://m.1010jiajiao.com/timu3_id_367892[举报]
(14分)现有碳酸钠和氯化钠的固体混合物,为了测定样品中碳酸钠的含量,化学兴趣小组同学分两组进行了以下实验。
第一组
实验装置
实验步骤
①连接好装置,检查气密性;
②盛装药品,其中样品a g,称量E的质量,连接好装置;
③关闭止水夹,向B中加入一定量稀硫酸;
④当B中充分反应后,打开止水夹,经过A装置,通入一定量的空气,将B、D中残余的气体全部赶入到E装置中;
⑤称量E,增重了b g 。
回答下列问题:
(1)仪器C的名称 ,D中盛放的试剂是 。
(2)B中发生反应的化学方程式为 。
(3)A中反应的离子方程式为 。
(4)改变下列一个条件,导致测定样品中的碳酸钠的质量百分含量偏低的是 (选填字母)
A.实验后期不通入空气 B.将仪器C中的硫酸换成盐酸
C.撤走仪器D D.撤走仪器F
第二组
实验装置
实验步骤
①检查装置气密性
②装好试剂,其中样品b g,连接好装置,将注射器的活塞推到底,即0mL处
③加入20mL硫酸,
④待反应充分进行后,活塞不在移动,记下活塞前端对应的刻度为V mL
回答下列问题
(1) 检查该装置气密性的方法是: 。
(2)对于产生气体的体积有两种观点,观点一:产生气体的体积为VmL;观点二:产生气体的体积为(V-20)mL,你认为 (填“观点一”“观点二”)正确。
(3)假如该实验在标准状况下进行,b=0.5g,V=76mL,则样品中碳酸钠的质量百分含量为 。
查看习题详情和答案>>
(14分)现有碳酸钠和氯化钠的固体混合物,为了测定样品中碳酸钠的含量,化学兴趣小组同学分两组进行了以下实验。
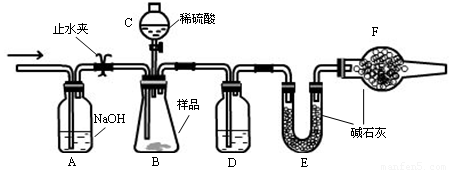
第一组
实验装置
实验步骤
①连接好装置,检查气密性;
②盛装药品,其中样品a g,称量E的质量,连接好装置;
③关闭止水夹,向B中加入一定量稀硫酸;
④当B中充分反应后,打开止水夹,经过A装置,通入一定量的空气,将B、D中残余的气体全部赶入到E装置中;
⑤称量E,增重了b g 。
回答下列问题:
(1)仪器C的名称 ,D中盛放的试剂是 。
(2)B中发生反应的化学方程式为 。
(3)A中反应的离子方程式为 。
(4)改变下列一个条件,导致测定样品中的碳酸钠的质量百分含量偏低的是 (选填字母)
A.实验后期不通入空气 B.将仪器C中的硫酸换成盐酸
C.撤走仪器D D.撤走仪器F
第二组
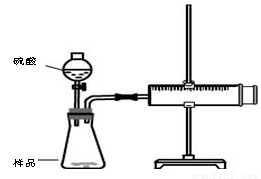
实验装置
实验步骤
①检查装置气密性
②装好试剂,其中样品b g,连接好装置,将注射器的活塞推到底,即0mL处
③加入20mL硫酸,
④待反应充分进行后,活塞不在移动,记下活塞前端对应的刻度为V mL
回答下列问题
(1) 检查该装置气密性的方法是: 。
(2)对于产生气体的体积有两种观点,观点一:产生气体的体积为VmL;观点二:产生气体的体积为(V-20)mL,你认为 (填“观点一”“观点二”)正确。
(3)假如该实验在标准状况下进行,b=0.5g,V=76mL,则样品中碳酸钠的质量百分含量为 。
查看习题详情和答案>>
Ⅰ.甲同学的方案如下图所示:
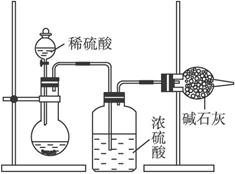
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进行_________次。
(2)甲同学重复测定了三次,得到碳酸钠的质量分数的数据存在较大的偏差,你认为原因可能是_________(填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足,则可能造成误差
Ⅱ.乙同学的方案是:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称量得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示) ___________________________。
(2)洗涤沉淀的操作要点是___________________________。
(3)Ca2+、Ba2+都可以使![]() 沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是___________________________;测定
沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是___________________________;测定![]() 的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是___________________________。
的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是___________________________。
(1)甲同学的方案是:将样品溶解,加入过量氯化钡溶液,过滤,将沉淀洗涤、烘干,称量所得固体质量为n g。
①检验沉淀已经洗净的方法为____________________________________________。
②此混合物中碳酸钠质量分数的计算式为_________________________________________。
(2)乙同学的方案是:将样品溶解,加入过量氯化钡溶液,再滴入2—3滴酚酞试液,用a mol/L标准盐酸滴定,到达滴定终点时消耗盐酸b mL。
①乙同学在滴定过程中所需要的主要玻璃仪器有______________、______________。
②此混合物中碳酸钠质量分数的计算式为______________。
(3)丙同学的方案如下图所示:
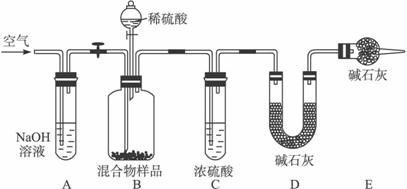
①装置C的作用是____________________________________________________。
②当混合物样品充分反应后,缓慢通入空气的目的是:_____________________________。
查看习题详情和答案>>碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe (OH)2 |
Fe (OH)3 |
|
开始沉淀pH |
4.2 |
5.8 |
1.2 |
|
完全沉淀pH |
6.7 |
8.3 |
3.2 |
(1)氯酸钠的作用是 ;滤渣的主要成分是 (写化学式)。
(2)调节反应A后溶液的pH范围应为 。可以选择的试剂是 (填序号)。
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是 。(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净? 。
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。
① 若沉淀只有CuCO3,则相应的离子方程式为 。
② 若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程 。
③ 若生成Cu(OH)2和CuCO3的混合物(即碱式盐)。则说明 。
(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成。步骤如下:
① 称量样品;② 高温分解;③ 测出CO2的质量;④ 测出水蒸汽的质量;⑤ 称量CuO。
请对上述测定方案作出评价。 。
查看习题详情和答案>>