题目内容
(14分)现有碳酸钠和氯化钠的固体混合物,为了测定样品中碳酸钠的含量,化学兴趣小组同学分两组进行了以下实验。
第一组
实验装置
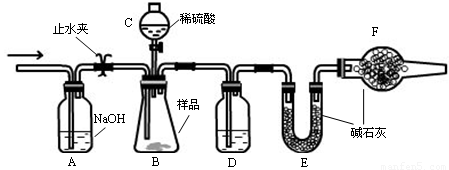
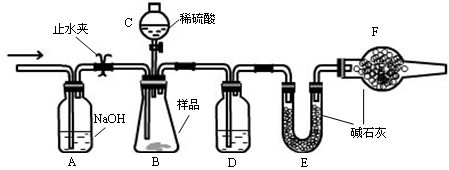
实验步骤
①连接好装置,检查气密性;
②盛装药品,其中样品a g,称量E的质量,连接好装置;
③关闭止水夹,向B中加入一定量稀硫酸;
④当B中充分反应后,打开止水夹,经过A装置,通入一定量的空气,将B、D中残余的气体全部赶入到E装置中;
⑤称量E,增重了b g 。
回答下列问题:
(1)仪器C的名称 ,D中盛放的试剂是 。
(2)B中发生反应的化学方程式为 。
(3)A中反应的离子方程式为 。
(4)改变下列一个条件,导致测定样品中的碳酸钠的质量百分含量偏低的是 (选填字母)
A.实验后期不通入空气 B.将仪器C中的硫酸换成盐酸
C.撤走仪器D D.撤走仪器F
第二组
实验装置
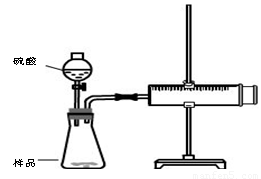
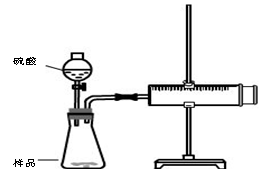
实验步骤
①检查装置气密性
②装好试剂,其中样品b g,连接好装置,将注射器的活塞推到底,即0mL处
③加入20mL硫酸,
④待反应充分进行后,活塞不在移动,记下活塞前端对应的刻度为V mL
回答下列问题
(1) 检查该装置气密性的方法是: 。
(2)对于产生气体的体积有两种观点,观点一:产生气体的体积为VmL;观点二:产生气体的体积为(V-20)mL,你认为 (填“观点一”“观点二”)正确。
(3)假如该实验在标准状况下进行,b=0.5g,V=76mL,则样品中碳酸钠的质量百分含量为 。
第一组
(1)分液漏斗(1分),浓硫酸(1分) (2)Na2CO3+H2SO4=Na2SO4+CO2↑+H2O (2分)
(3)CO2+2OH-=CO32-+H2O (2分) (4)A (2分)
第二组
(1)连接好装置,关闭分液漏斗的活塞,将注射器的活塞向外拉一段距离,松开活塞后,若活塞最终回到原来的位置,即证明气密性良好,否则气密性不好。(2分)
(2)观点二(2分) (3)53%(2分)
【解析】

工业碳酸钠由于在生产过程中原料盐和工艺等的原因,常会含有Na2SO4、NaCl中的一种或两种杂质。现有工业碳酸钠样品,某化学兴趣小组就工业碳酸钠中是否含有这两种杂质进行探究。实验室有以下的仪器和药品可供使用:
烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:1.0 mol·L-1H2SO4、1.0 mol·L-1HNO3、1.0mol·L-1HCl、NaOH稀溶液、0.1 mol·L-1AgNO3、0.1 mol·L-1BaCl2 、0.1 mol·LBa(NO3)2、蒸馏水。以下是部分实验探究过程:
1)提出假设:
假设1 白色粉末为 的混合物;
假设2 白色粉末为 的混合物;
假设3 白色粉末为碳酸钠、硫酸钠、氯化钠的混合物;
2)基于假设设计实验方案
3)根据实验方案进行实验
请回答:
(1)某同学取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1 mol·L-1的BaCl2溶液,有白色沉淀产生,他认为样品中含有Na2SO4。你认为他的结论是 (填“对的”或“错的”),原因是: 。
(2)设计实验方案
基于工业碳酸钠中两种杂质均存在这一假设,设计出实验方案(在答题卡上作答)。
| 编号 | 实验操作 | 预期现象和结论 |
| ① |
| 有无色气体产生,说明样品中含有Na2CO3。 若无气体产生,说明样品中没有Na2CO3。
|
| ② |
|
|
| ③ |
|
|