摘要:12].C1SO3H称为氯磺酸.是一种强酸.对于反应:ClSO3H+HCOOH=CO+HCl+H2SO4有如下判断.其中较合理的是 A.此反应属于氧化还原反应 B.此反应不属于氧化还原反应 C.反应后溶液的pH值变小 D.反应后溶液的pH值增大
网址:http://m.1010jiajiao.com/timu3_id_36772[举报]
Ba2+为重金属离子,对人体剧毒,医学上在进行胃肠疾病的检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视.
Ⅰ.请写出BaSO4能作为钡餐透视的另外一个理由:
Ⅱ.请用文字叙述和离子方程式说明钡餐透视时为什么不用BaCO3?
Ⅲ.某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:
①5mL水
②20mL 0.5mol?L-1的Na2SO4溶液
③40mL 0.2mol?L-1的Ba(OH)2溶液
④40mL 0.1mol?L-1的H2SO4溶液中,溶解至饱和.
(1)以上各溶液中,c(Ba2+)的大小顺序正确的是
A.③>①>④>②B.③>①>②>④C.①>④>③>②D.①>③>④>②
(2)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO
)为
(3)某同学取溶液③和溶液④直接混合,则混合溶液的pH为
查看习题详情和答案>>
Ⅰ.请写出BaSO4能作为钡餐透视的另外一个理由:
BaSO4既不溶于水,也不溶于酸,可经人体排出体外,不会引起Ba2+中毒
BaSO4既不溶于水,也不溶于酸,可经人体排出体外,不会引起Ba2+中毒
.Ⅱ.请用文字叙述和离子方程式说明钡餐透视时为什么不用BaCO3?
BaCO3遇到胃酸生成Ba2+会使人中毒,反应离子方程式为:
BaCO3+2H+=Ba2++H2O+CO2↑
BaCO3+2H+=Ba2++H2O+CO2↑
BaCO3遇到胃酸生成Ba2+会使人中毒,反应离子方程式为:
BaCO3+2H+=Ba2++H2O+CO2↑
.BaCO3+2H+=Ba2++H2O+CO2↑
Ⅲ.某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:
①5mL水
②20mL 0.5mol?L-1的Na2SO4溶液
③40mL 0.2mol?L-1的Ba(OH)2溶液
④40mL 0.1mol?L-1的H2SO4溶液中,溶解至饱和.
(1)以上各溶液中,c(Ba2+)的大小顺序正确的是
A
A
,BaSO4的溶解度的大小顺序为C
C
(填序号).A.③>①>④>②B.③>①>②>④C.①>④>③>②D.①>③>④>②
(2)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO
2- 4 |
5.5×10-10mol?L-1
5.5×10-10mol?L-1
,溶液②中c(Ba2+)为2.2×10-10mol?L-1
2.2×10-10mol?L-1
.(3)某同学取溶液③和溶液④直接混合,则混合溶液的pH为
13
13
(假设混合后溶液的体积为混合前两溶液的体积之和).(2011?佛山一模)多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热.研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有铁、镁等离子)制备BaCl2?2H2O,工艺流程如下.
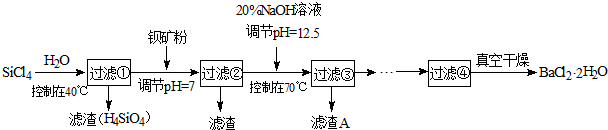
已知:①常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4.
②M (BaCO3)=197g/mol,M(BaCl2?2H2O)=244g/mol
(1)SiCl4水解反应的方程式为
SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol
则由SiCl4制备硅的热化学方程式为
(2)加钡矿粉并调节pH=7的作用是使BaCO3转化为BaCl2和
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是
(4)BaCl2滤液经
(5)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2?2H2O
查看习题详情和答案>>

已知:①常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4.
②M (BaCO3)=197g/mol,M(BaCl2?2H2O)=244g/mol
(1)SiCl4水解反应的方程式为
SiCl4+4H2O=H4SiO4↓+4HCl
SiCl4+4H2O=H4SiO4↓+4HCl
.已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol
则由SiCl4制备硅的热化学方程式为
SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol
SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol
.(2)加钡矿粉并调节pH=7的作用是使BaCO3转化为BaCl2和
使Fe3+完全沉淀
使Fe3+完全沉淀
.(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是
Mg(OH)2
Mg(OH)2
.(4)BaCl2滤液经
蒸发浓缩
蒸发浓缩
、过滤
过滤
、过滤、洗涤,再经真空干燥后得到BaCl2?2H2O.(5)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2?2H2O
9.76
9.76
吨.如图表示配制100mL0.100mol′L-1Na2CO3溶液几个关键实验步骤和操作,据图回答下列问题:

(1)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是
(2)步骤B通常称为转移,步骤A通常称为
(3)将上述实验步骤A→F按实验过程先后次序排列
(4)在配制Na2CO3溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度
(5)若要配制100mL 2.3mol/L的稀硫酸,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
查看习题详情和答案>>

(1)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是
容量瓶
容量瓶
.(2)步骤B通常称为转移,步骤A通常称为
定容
定容
.(3)将上述实验步骤A→F按实验过程先后次序排列
DCBFAE
DCBFAE
(4)在配制Na2CO3溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度
小于
小于
0.1mol/L(填“大于”“等于”或“小于”).(5)若要配制100mL 2.3mol/L的稀硫酸,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
12.5
12.5
mL.如果实验室有10mL、25mL、50mL量筒,应选用25
25
mL规格的量筒最好.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物.PM2.5粒径小,富含大量的有毒、有害物质且在大气中停留时间长,因而对人体健康和大气环境质量影响更大.下列有关说法不正确的( )
查看习题详情和答案>>
(1)一定温度下,向1L 0.1mol?L-1 CH3COOH溶液中加入0.1mol CH3COONa固体,则醋酸的电离平衡向
的值
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3?H2O.已知:
a.常温下,醋酸和NH3?H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O.
则CH3COONH4溶液呈
(3)99℃时,Kw=1.0×10-12,该温度下测得0.1mol?L-1 Na2A溶液的pH=6.
①H2A在水溶液中的电离方程式为
②该温度下,将0.01mol?L-1 H2A溶液稀释到20倍后,溶液的pH=
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气
A.盐酸多 B.H2A多
C.一样多 D.无法确定
④将0.1mol?L-1 H2A溶液与0.2mol?L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为
查看习题详情和答案>>
逆
逆
(填“正”或“逆”)反应方向移动;溶液中| c(CH3COO-)?c(H+) | c(CH3COOH) |
不变
不变
(填“增大”、“减小”或“不变”).(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3?H2O.已知:
a.常温下,醋酸和NH3?H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O.
则CH3COONH4溶液呈
中
中
性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈碱
碱
性,NH4HCO3溶液中物质的量浓度最大的离子是NH4+
NH4+
(填化学式).(3)99℃时,Kw=1.0×10-12,该温度下测得0.1mol?L-1 Na2A溶液的pH=6.
①H2A在水溶液中的电离方程式为
H2A═2H++A2-
H2A═2H++A2-
.②该温度下,将0.01mol?L-1 H2A溶液稀释到20倍后,溶液的pH=
3
3
.③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气
C
C
.A.盐酸多 B.H2A多
C.一样多 D.无法确定
④将0.1mol?L-1 H2A溶液与0.2mol?L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为
c(NH4+)>c(A2-)>c(H+)>c(OH-)
c(NH4+)>c(A2-)>c(H+)>c(OH-)
.