摘要:4].已知:2Fe+3Br2=2FeBr3 2Fe3++2I-=2Fe2++I2.现将Fe(NO3)2溶液分别滴入到以下溶液中:①H2SO4 ②HNO3 ③溴水 ④碘水.其中能使Fe2+转变成Fe3+的是 A.只有②③ B.①②③ C.②③④ D.全部
网址:http://m.1010jiajiao.com/timu3_id_36764[举报]
 钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料.已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如图:
钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料.已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如图:(1)铁在元素周期表中位于
四
四
周期Ⅷ
Ⅷ
族.(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有:
cdb
cdb
(选用右图中的a、b、c、d填空).(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是
acd
acd
.(a)其它条件不变,增加高炉的高度
(b)调节还原时的炉温
(c)增加原料中焦炭与赤铁矿的比例
(d)将生成的铁水及时移出
(4)已知下列反应数值:
| 反应序号 | 化学反应 | 反应热 |
| ① | Fe2O3(s)+3CO(g)=2Fe(s)+3CO 2(g) | △H1=-26.7kJ?mol-1 |
| ② | 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) | △H2=-50.8kJ?mol-1 |
| ③ | Fe3O4(s)+CO(g)=3FeO(s)+CO2 (g) | △H3=-36.5kJ?mol-1 |
| ④ | FeO(s)+CO(g)=Fe(s)+CO2(g) | △H4 |
7.3
7.3
kJ?mol-1.(5)1100℃时,FeO(s)+CO(g)?Fe(s)+CO2(g),平衡常数K=0.4.今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:
57.1
57.1
.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2(g)+3H2 (g)?2NH3(g)△H=a kJ?mol-1.试根据表中所列键能数据计算a为
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+02(g)=C02(g);△H1=-393.5kJ?mol-1
2H2(g)+02(g)=2H20(l);△H2=-571.6kJ?mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l);△H3=-2599kJ?mol-1
根据盖斯定律,计算298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:△H=
(4)已知热化学方程式:
①Fe2O3(s)+3CO(s)=2Fe(s)+3CO2(g);△H=-25kJ/mol
②3Fe2O3(s)+CO(s)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③Fe3O4(s)+CO(s)=4FeO(s)+CO2(g);△H=+19kJ/mol
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
查看习题详情和答案>>
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=-1452.8kJ?mol-1
2CH30H(l)+302(g)=2C02(g)+4H20(l)△H=-1452.8kJ?mol-1
.(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N | 键能/kJ?mol-1 | 436 | 391 | 946 |
-92
-92
.(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+02(g)=C02(g);△H1=-393.5kJ?mol-1
2H2(g)+02(g)=2H20(l);△H2=-571.6kJ?mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l);△H3=-2599kJ?mol-1
根据盖斯定律,计算298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:△H=
+226.7kJ?mol-1
+226.7kJ?mol-1
.(4)已知热化学方程式:
①Fe2O3(s)+3CO(s)=2Fe(s)+3CO2(g);△H=-25kJ/mol
②3Fe2O3(s)+CO(s)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③Fe3O4(s)+CO(s)=4FeO(s)+CO2(g);△H=+19kJ/mol
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
FeO(s)+CO(s)=Fe(s)+C02(g)△H=-11kJ/mol
FeO(s)+CO(s)=Fe(s)+C02(g)△H=-11kJ/mol
.利用染化厂的废料铁泥(主要成分是Fe2O3、FeO和铁)制备可用于隐形飞机涂层的纳米四氧化三铁的生产流程为图1:
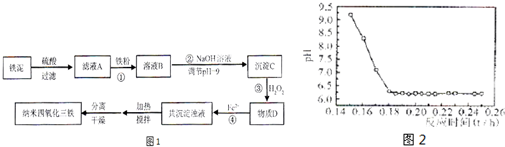
请回答:
(1)过程①主要反应的离子方程式为
(2)已知氢氧化亚铁的Ksp=4.87×10-17,氢氧化铁的Ksp=2.6×10-39.当溶液中某离子浓度不高于1×10-5 mol?L-1时,可以认为该离子已经完全沉淀.通过计算所得数据说明过程②调节pH=9的原因是
(3)物质D的主要产物中铁、氢、氧三种元素的质量比为56:1:32,则过程③主要反应的化学方程式为
(4)已知Fe2+在弱碱性溶液中还原性较强,图2是研究过程④的实验所得,则该反应所需的时间控制在
(5)某工厂处理废铁泥(测得铁元素含量为16.8%)的能力为10吨/小时,生产纳米四氧化三铁的产量为4.64吨/小时.如不考虑过程④以后生产中Fe2+的氧化,则该工厂每小时消耗铁粉的质量为
查看习题详情和答案>>

请回答:
(1)过程①主要反应的离子方程式为
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.(2)已知氢氧化亚铁的Ksp=4.87×10-17,氢氧化铁的Ksp=2.6×10-39.当溶液中某离子浓度不高于1×10-5 mol?L-1时,可以认为该离子已经完全沉淀.通过计算所得数据说明过程②调节pH=9的原因是
当pH=9时,Fe2+的浓度为5×10-5mol?L-1,已完全沉淀
当pH=9时,Fe2+的浓度为5×10-5mol?L-1,已完全沉淀
.(3)物质D的主要产物中铁、氢、氧三种元素的质量比为56:1:32,则过程③主要反应的化学方程式为
2Fe(OH)2+H2O2=2FeO(OH)+2H2O
2Fe(OH)2+H2O2=2FeO(OH)+2H2O
.(4)已知Fe2+在弱碱性溶液中还原性较强,图2是研究过程④的实验所得,则该反应所需的时间控制在
0.16
0.16
小时左右,较为适宜.(5)某工厂处理废铁泥(测得铁元素含量为16.8%)的能力为10吨/小时,生产纳米四氧化三铁的产量为4.64吨/小时.如不考虑过程④以后生产中Fe2+的氧化,则该工厂每小时消耗铁粉的质量为
560
560
千克. 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).| 化学键 | Cl-Cl | H-H | H-Cl | N≡N |
| 键能/kJ?mol | 243 | 436 | 431 | 946 |
a 2HCl(g)=H2(g)+Cl2(g);△H=
+183kJ/mol
+183kJ/mol
b N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,则N-H键的键能是
391
391
kJ?mol(2)1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)
NO2(g)+CO(g)=CO2(g)+NO(g)
△H=-234kJ?mol-1
△H=-234kJ?mol-1
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO (g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
(4)已知:2Al (s)+
| 3 |
| 2 |
2Fe (s)+
| 3 |
| 2 |
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式
2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJmol-1
2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJmol-1
.某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2.该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量氧气 O2,该同学推测反应中可能生成了H2O2,并进行实验探究.
(1)试设计实验证明溶液X中含过氧化氢
(2)通过上述实验证明溶液中确实存在H2O2.取少量X于试管中,滴加几滴酚酞试液,实验现象为
(3)取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,则该反应的离子方程式为
(4)已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,完成并配平该反应的离子方程式:
查看习题详情和答案>>
(1)试设计实验证明溶液X中含过氧化氢
取少量X于试管中,加入少量MnO2固体,用带火星的木条检验生成的O2
取少量X于试管中,加入少量MnO2固体,用带火星的木条检验生成的O2
.(2)通过上述实验证明溶液中确实存在H2O2.取少量X于试管中,滴加几滴酚酞试液,实验现象为
酚酞先变红,又褪色
酚酞先变红,又褪色
.(3)取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,则该反应的离子方程式为
H2O2+2Fe2++4OH-=2Fe(OH)3↓
H2O2+2Fe2++4OH-=2Fe(OH)3↓
.(4)已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,完成并配平该反应的离子方程式:
2
2
MnO4-+5
5
H2O2+6
6
H+-2
2
Mn2++5
5
O2↑+8
8
H2O
H2O
.