网址:http://m.1010jiajiao.com/timu3_id_36734[举报]
某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升.若用同样的铝片投入同浓度的硫酸
铜溶液中,在短时间内铝片无明显变化.
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是______.(填序号)
A.生成氯化铝溶于水,而生成硫酸铝不溶于水
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
(2)铝片表面出现的暗红色物质是______.
(3)放出的气体是______,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的其中一种原因是______.
(4)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是______.
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
(5)除去氧化铝的铝片与镁片为电极,在 X 电解质溶液中构成原电池,列表如下:
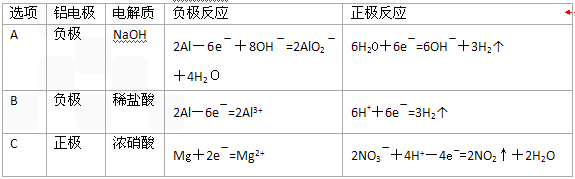
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 负极 | NaOH | 2Al-6e-+8OH-=2AlO2-+4H2O | 6H2O+6e-=6OH-+3H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Mg+2e-=Mg2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是_______。(填序号)
A. 铝与Cl--反应,铝与SO42--不反应
B. 氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C. 硫酸铜水解生成硫酸使铝钝化
D. 氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E. 生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是_______。
(3)放出的气体是_______,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是_______。
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是_______。
A. 用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B. 把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C. 向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D. 在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)除去氧化铝的铝片与镁片为电极,在X电解质溶液中构成原电池,列表如下:
铜溶液中,在短时间内铝片无明显变化.
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是 .(填序号)
A.生成氯化铝溶于水,而生成硫酸铝不溶于水
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
(2)铝片表面出现的暗红色物质是 .
(3)放出的气体是 ,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的其中一种原因是 .
(4)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是 .
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
(5)除去氧化铝的铝片与镁片为电极,在 X 电解质溶液中构成原电池,列表如下:
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 负极 | NaOH | 2Al-6e-+8OH-=2AlO2-+4H2O | 6H2O+6e-=6OH-+3H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Mg+2e-=Mg2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
阅读下面两条科普信息,回答有关问题:
一个体重50kg的健康人身体中含铁2g,这2g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收:
在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿:该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)。
(1)这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明维生素C具有 性,铁离子具有 性,第二则则信息中CO2是 剂。
(2)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
__Fe(NO3)3 +__ NaOH+ __Cl2 → __Na2FeO4+ __NaNO3 + __NaCl + __H2O
①配平上述反应,并分析 元素被氧化,当生成3mol还原产物时,转移电子的总数为 ;
②铁酸钠除了能消毒外,还可以用于净水,原因是 。
查看习题详情和答案>>阅读下面两条科普信息,回答有关问题:
一个体重50kg的健康人身体中含铁2g,这2g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收:
在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿:该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)。
(1)这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明维生素C具有 性,铁离子具有 性,第二则则信息中CO2是 剂。
(2)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
__Fe(NO3)3 +__ NaOH+ __Cl2 → __Na2FeO4+__NaNO3 + __NaCl + __H2O
①配平上述反应,并分析 元素被氧化,当生成3mol还原产物时,转移电子的总数为 ;
②铁酸钠除了能消毒外,还可以用于净水,原因是 。
查看习题详情和答案>>