摘要:29.A: B: (2)C→D: F→G:
网址:http://m.1010jiajiao.com/timu3_id_366592[举报]
A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同主族元素.A、F两元素的原子核中质子数之和比C、D两元素的原子核中质子数之和少2.F元素的最外层电子数是其次外层电子数的
.又知B元素的最外层电子数是内层电子数的2倍.E元素的最外层电子数等于其电子层数.请回答:
(1)写出元素A和B形成的直线型非极性分子的电子式:
 .
.
(2)已知:泡沫灭火器的工作原理是含有A、B、C、D四种元素形成的化合物X和含有C、E、F三种元素形成的Y的水溶液间的反应,写出该反应的离子方程式:
(3)工业上制备单质E,是通过电解C和E形成的化合物;写出阴极上的电极反应式:
(4)1mol由E、F两种元素组成的化合物跟由A、C、D三种元素组成的化合物的溶液恰好完全反应,则消耗后者化合物的物质的量为
(5)含有溶质为DAB2C4的水溶液显酸性的原因是
(6)若G是周期表中第四周期第Ⅷ族的金属元素,其最高价氧化物与单质E反应的化学方程式是
查看习题详情和答案>>
| 3 |
| 4 |
(1)写出元素A和B形成的直线型非极性分子的电子式:


(2)已知:泡沫灭火器的工作原理是含有A、B、C、D四种元素形成的化合物X和含有C、E、F三种元素形成的Y的水溶液间的反应,写出该反应的离子方程式:
3HCO3-+Al3+═3CO2↑+Al(OH)3↓
3HCO3-+Al3+═3CO2↑+Al(OH)3↓
.(3)工业上制备单质E,是通过电解C和E形成的化合物;写出阴极上的电极反应式:
Al3++3e-═Al
Al3++3e-═Al
.(4)1mol由E、F两种元素组成的化合物跟由A、C、D三种元素组成的化合物的溶液恰好完全反应,则消耗后者化合物的物质的量为
8
8
mol.(5)含有溶质为DAB2C4的水溶液显酸性的原因是
HC2O4-的电离大于水解
HC2O4-的电离大于水解
.(6)若G是周期表中第四周期第Ⅷ族的金属元素,其最高价氧化物与单质E反应的化学方程式是
2Al+Fe2O3
Al2O3+2Fe
| ||
2Al+Fe2O3
Al2O3+2Fe
.
| ||
A、B、C、D、E、F、G全为短周期元素,它们在中学常见化合物中显示的部分化合价及原子、离子半径从大到小的序号如下:(注:半径按①、②、③…的顺序依次减小)
(1)用电子式表示BA2的形成过程
 .
.
(2)写出F的最高价氧化物对应的水化物和G的最高价氧化物对应的水化物反应的离子方程式
(3)请设计实验比较B、F的活动性强弱.
查看习题详情和答案>>
| 元素 性质 |
A | B | C | D | E | F | G |
| 化合价 | +1、+5、+7 | 只有+2 | +4 | -3、+2、+4、+5 | 只有-1 | 只有+3 | 只有+1 |
| 原子半径 | ⑤ | ② | ④ | ⑥ | ⑦ | ③ | ① |
| 离子半径 | ① | ⑤ | 无离子 | ② | ③ | ⑥ | ④ |


(2)写出F的最高价氧化物对应的水化物和G的最高价氧化物对应的水化物反应的离子方程式
Al(OH)3+OH-═AlO2-+2H2O.
Al(OH)3+OH-═AlO2-+2H2O.
.(3)请设计实验比较B、F的活动性强弱.
| 元素 | 实验设计 | 现象 | 结论 |
| B | 活动性:B F (填“>”、“<”或“=”) | ||
| F |
A、B、C、D、E、F、G为常见物质,其中C为淡黄色固体.甲、乙、丙为常见气体.各物质的转化关系如图所示.

回答下列问题:
(1)C的名称是
A+甲→C的反应条件是
(2)在一定条件下,甲+乙→F,该反应属于
①氧化还原反应 ②非氧化还原反应 ③化合反应 ④分解反应 ⑤复分解反应 ⑥置换反应 ⑦离子反应
(3)写出下列变化的离子方程式.
①A+F→E+乙:
②D+F+丙→G:
查看习题详情和答案>>

回答下列问题:
(1)C的名称是
过氧化钠
过氧化钠
;D的俗称纯碱(或苏打)
纯碱(或苏打)
;F的化学式H2O
H2O
;A+甲→C的反应条件是
点燃
点燃
.(2)在一定条件下,甲+乙→F,该反应属于
①③
①③
.①氧化还原反应 ②非氧化还原反应 ③化合反应 ④分解反应 ⑤复分解反应 ⑥置换反应 ⑦离子反应
(3)写出下列变化的离子方程式.
①A+F→E+乙:
2Na+2H2O═2Na++2OH-+H2↑
2Na+2H2O═2Na++2OH-+H2↑
.②D+F+丙→G:
CO32-+H2O+CO2═2HCO3-
CO32-+H2O+CO2═2HCO3-
.A、B、C、D、E、F、G、H、I、J分别代表十种不同的有机物(其中A是化学工业重要原料之一).它们之间的相互转化关系如图: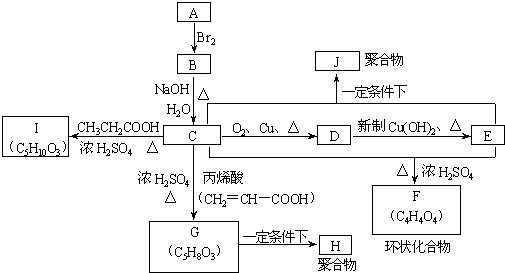
请回答下列问题:
(1)A的结构式简为
 ;指G→H的反应类型
;指G→H的反应类型
(2)写出下列转化的化学方程式.
①C→I
②C+E→J
(3)G有多种同分异构体,其中能与NaOH溶液及硫酸溶液均可反应;能发生银镜反应且生成的银与相应有机物的物质的量比为4:1,由符合条件的同分异构体数目有
查看习题详情和答案>>

请回答下列问题:
(1)A的结构式简为
CH2=CH2
CH2=CH2
;F的结构简式为

加聚反应
加聚反应
.(2)写出下列转化的化学方程式.
①C→I
CH3CH2COOH+HOCH2CH2OH
CH3CH2COOCH2CH2OH+H2O
| 浓硫酸 |
| △ |
CH3CH2COOH+HOCH2CH2OH
CH3CH2COOCH2CH2OH+H2O
| 浓硫酸 |
| △ |
②C+E→J
nCH2OHCH2CH2OH+nHOOCCOOH
 +(2n-1)H2O
+(2n-1)H2O
| 催化剂 |
 +(2n-1)H2O
+(2n-1)H2OnCH2OHCH2CH2OH+nHOOCCOOH
 +(2n-1)H2O
+(2n-1)H2O
| 催化剂 |
 +(2n-1)H2O
+(2n-1)H2O(3)G有多种同分异构体,其中能与NaOH溶液及硫酸溶液均可反应;能发生银镜反应且生成的银与相应有机物的物质的量比为4:1,由符合条件的同分异构体数目有
5
5
种,写出其中的一种同分异构体结构简式HCOOCH2CH2CH2CHO
HCOOCH2CH2CH2CHO
.A~L为中学化学常见的物质,其主要转化关系如图所示(其中产物水已略去).已知A为常见的金属单质,C、D通常状况下为气体单质,B、F均为重要的化工产品,B的浓溶液具有较强的腐蚀性,F为具有刺激性气味的气体.将一定量的F通入B的稀溶液中可以生成两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
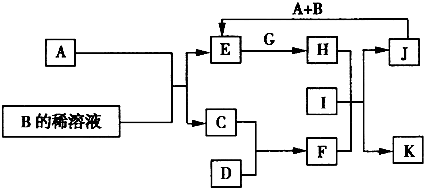
试回答下列问题:
(1)B的化学式为
(2)向E的溶液中加入氢氧化钠溶液的实验现象为
(3)写出E的酸性溶液与G反应生成H的离子方程式:
(4)检验H溶液中的阳离子应选用试剂为,实验现象为
(5)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为pH(K溶液)
查看习题详情和答案>>

试回答下列问题:
(1)B的化学式为
H2SO4
H2SO4
;工业上冶炼金属A的方法称为热还原法
热还原法
.(2)向E的溶液中加入氢氧化钠溶液的实验现象为
先生成白色沉淀,迅速变为灰绿色,最后变为红褐色
先生成白色沉淀,迅速变为灰绿色,最后变为红褐色
,发生反应的化学方程式为FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(3)写出E的酸性溶液与G反应生成H的离子方程式:
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.(4)检验H溶液中的阳离子应选用试剂为,实验现象为
溶液由黄色变为血红色
溶液由黄色变为血红色
.(5)相同条件下物质的量浓度相同的K、L溶液的pH大小关系为pH(K溶液)
>
>
pH(L溶液)(填“>”、“<”或“=”),其主要原因是NH4++H2O?NH3?H2O+H+,HSO4-═H++SO42-
NH4++H2O?NH3?H2O+H+,HSO4-═H++SO42-
(用离子方程式解释).