摘要:24.氧化性逐渐减弱 Cl2+2Br-=2Cl-+Br2 (2)随着相对分子质量增大.沸点逐渐升高 (3)HF.H2O 分子之间易形成氢键
网址:http://m.1010jiajiao.com/timu3_id_366512[举报]
(2012?天津模拟)某研究小组欲探究SO2的化学性质,设计了如下实验方案.
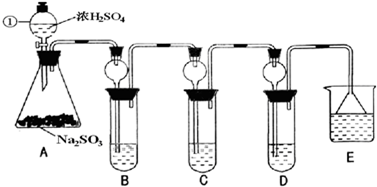
(1)指出仪器①的名称
(2)检查A装置的气密性的方法是
(3)装置B检验SO2的氧化性,则B中所盛试剂可以为
(4)装置C中盛装溴水用以检验SO2的
(5)装置D中盛装新制漂白粉浓溶液通入SO2一段吋间后,D中出现了大量白色沉淀.同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3
假设二:该白色沉淀为
假设三:该白色沉淀为上述两种物质的混合物.
②基于假设一,同学们对白色沉淀成分进行了探究.设计如下方案:
限选的仪器和试剂;过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5mol.L-1 HCl、0.5mol.L-1 H2SO4、0.5mol.L-1BaCl2、1mol.L-1 NaOH、品红溶液.
第1步,将D中沉淀过滤、洗涤干净,备用.
请回答洗涤沉淀的方法:
第2步,用另一只干净试管取少量沉淀样品,加入
若出现
③若假设二成立,试写出生成该白色沉淀的化学方程式:
(6)装置E中盛放的试剂是
查看习题详情和答案>>

(1)指出仪器①的名称
分液漏斗
分液漏斗
.(2)检查A装置的气密性的方法是
关闭分液漏斗活塞,将导管末端插入B试管水中,用手捂住锥形瓶,若在导管口有气泡冒出,松开手后导管中上升一段水柱,则表明装置A气密性良好
关闭分液漏斗活塞,将导管末端插入B试管水中,用手捂住锥形瓶,若在导管口有气泡冒出,松开手后导管中上升一段水柱,则表明装置A气密性良好
.(3)装置B检验SO2的氧化性,则B中所盛试剂可以为
硫化氢水溶液(或硫化钠、硫氢化钠溶液均可)
硫化氢水溶液(或硫化钠、硫氢化钠溶液均可)
.(4)装置C中盛装溴水用以检验SO2的
还原
还原
性,则C中反应的离子方程式为SO2+Br2+2H2O=SO42-+4H++2Br-
SO2+Br2+2H2O=SO42-+4H++2Br-
.(5)装置D中盛装新制漂白粉浓溶液通入SO2一段吋间后,D中出现了大量白色沉淀.同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3
假设二:该白色沉淀为
CaSO4
CaSO4
.假设三:该白色沉淀为上述两种物质的混合物.
②基于假设一,同学们对白色沉淀成分进行了探究.设计如下方案:
限选的仪器和试剂;过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5mol.L-1 HCl、0.5mol.L-1 H2SO4、0.5mol.L-1BaCl2、1mol.L-1 NaOH、品红溶液.
第1步,将D中沉淀过滤、洗涤干净,备用.
请回答洗涤沉淀的方法:
沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水流尽后重复2~3次以上操作
沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水流尽后重复2~3次以上操作
.第2步,用另一只干净试管取少量沉淀样品,加入
过量(或适量)0.5mol.L-1HCl、
过量(或适量)0.5mol.L-1HCl、
(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有品红溶液
品红溶液
(试剂)的试管中.若出现
若固体完全溶解,有气泡产生,且能使品红溶液褪色
若固体完全溶解,有气泡产生,且能使品红溶液褪色
现象,则假设一成立.③若假设二成立,试写出生成该白色沉淀的化学方程式:
Ca(ClO)2+H2O+SO2=CaSO4+2HCl
Ca(ClO)2+H2O+SO2=CaSO4+2HCl
.(6)装置E中盛放的试剂是
NaOH溶液
NaOH溶液
,作用是吸收SO2,防止造成空气污染
吸收SO2,防止造成空气污染
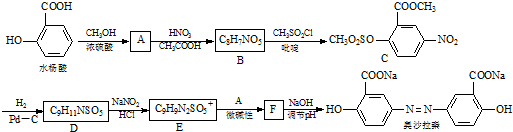
.(2009?南京二模)奥沙拉秦是一种抗菌药.其合成路线如下:
已知:①
②NaNO2具有强氧化性
(1)写出水杨酸→A反应的化学方程式: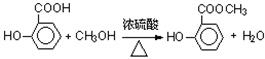

(2)E的结构简式: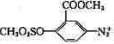

(3)从整个合成路线看,设计B→C步骤的作用是:
(4)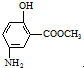 也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3发生显色反应,其核磁共振氢谱有6个吸收峰.X的结构简式为
也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3发生显色反应,其核磁共振氢谱有6个吸收峰.X的结构简式为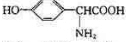

(5)苏丹红1号(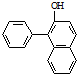 )是一种化工染料.写出以苯和β-萘酚(
)是一种化工染料.写出以苯和β-萘酚( 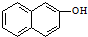 )为原料(其他无机试剂任选),合成苏丹红1号的合成路线.
)为原料(其他无机试剂任选),合成苏丹红1号的合成路线.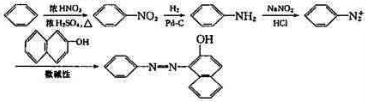
 .
.
查看习题详情和答案>>

已知:①

②NaNO2具有强氧化性
(1)写出水杨酸→A反应的化学方程式:


(2)E的结构简式:


(3)从整个合成路线看,设计B→C步骤的作用是:
保护酚羟基,防止被NaNO2氧化
保护酚羟基,防止被NaNO2氧化
(4)
 也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3发生显色反应,其核磁共振氢谱有6个吸收峰.X的结构简式为
也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3发生显色反应,其核磁共振氢谱有6个吸收峰.X的结构简式为

(5)苏丹红1号(
 )是一种化工染料.写出以苯和β-萘酚(
)是一种化工染料.写出以苯和β-萘酚(  )为原料(其他无机试剂任选),合成苏丹红1号的合成路线.
)为原料(其他无机试剂任选),合成苏丹红1号的合成路线.

(2009?北京)某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
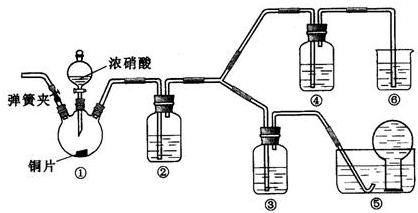
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是
(5)该小组得出的结论依据的试验现象是
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色.甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体.同学们分别涉及了一下4个试验来判断两种看法是否正确.这些方案中可行的是
a)加热该绿色溶液,观察颜色变化
b)加水稀释绿色溶液,观察颜色变化
c)向该绿色溶液中通入氮气,观察颜色变化
d)向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化.
查看习题详情和答案>>

可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
3mol/L稀硝酸、浓硝酸、氢氧化钠溶液
3mol/L稀硝酸、浓硝酸、氢氧化钠溶液
(2)滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内
通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内
(3)装置①中发生反应的化学方程式是
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(4)装置②的作用是
将NO2转化为NO
将NO2转化为NO
,发生反应的化学方程式是3NO2 +H2O=2HNO3 +NO
3NO2 +H2O=2HNO3 +NO
(5)该小组得出的结论依据的试验现象是
装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色.甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体.同学们分别涉及了一下4个试验来判断两种看法是否正确.这些方案中可行的是
acd
acd
(填序号字母,多选不给分)a)加热该绿色溶液,观察颜色变化
b)加水稀释绿色溶液,观察颜色变化
c)向该绿色溶液中通入氮气,观察颜色变化
d)向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化.
 铁是人类生产和生活中必不可少的重要金属(如图).
铁是人类生产和生活中必不可少的重要金属(如图).(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为
(2)铁原子中有
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:
(6)0.03mol的铁加到过量的HNO3中,加热,铁完全溶解,若生成NO、NO2的混和气体共1.12L(标准状况).将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积
已知:
RCHO+CH2(COOH)2
RCH=C(COOH)2+H2O
RCH=C(COOH)2
RCH=CHCOOH+CO2↑
A与芳香族化合物B在一定条件下反生成C,进一步反应生成抗氧化剂阿魏酸(见下图)

A的相对分子质量是104,1molA与足量NaHCO3溶液反应生成2mol气体.
(1)A的结构简式是
(2)在中学学过知识里 B不可能发生的反应是
a、取代反应 b、加成反应c、氧化反应d、还原反应e、水解反应 f、显色反应
(3)等物质的量C分别与足量的Na、浓溴水、NaOH、NaHCO3反应时消耗Na、Br2、NaOH、NaHCO3的物质的量之比是
(4)写出C与足量的Na2CO3的化学方程式为:

(5)写出符合下列条件的阿魏酸的一种同分异构体的结构简式:
 .
.
①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO2气体;
(6)写出利用阿魏酸在一定条件下生成抗氧化性的高分子化合物的方程式:
 .
.
查看习题详情和答案>>
RCHO+CH2(COOH)2
| 一定条件 |
RCH=C(COOH)2
| 一定条件 |
A与芳香族化合物B在一定条件下反生成C,进一步反应生成抗氧化剂阿魏酸(见下图)

A的相对分子质量是104,1molA与足量NaHCO3溶液反应生成2mol气体.
(1)A的结构简式是
CH2(COOH)2
CH2(COOH)2
.(2)在中学学过知识里 B不可能发生的反应是
e
e
(填序号)a、取代反应 b、加成反应c、氧化反应d、还原反应e、水解反应 f、显色反应
(3)等物质的量C分别与足量的Na、浓溴水、NaOH、NaHCO3反应时消耗Na、Br2、NaOH、NaHCO3的物质的量之比是
3:2:3:2
3:2:3:2
(4)写出C与足量的Na2CO3的化学方程式为:


(5)写出符合下列条件的阿魏酸的一种同分异构体的结构简式:


①在苯环上只有两个取代基;
②在苯环上的一氯取代物只有两种;
③1mol该同分异构体与足量NaHCO3反应生成2mol CO2气体;
(6)写出利用阿魏酸在一定条件下生成抗氧化性的高分子化合物的方程式:

