网址:http://m.1010jiajiao.com/timu3_id_365971[举报]

①配制0.1 mol·L-1盐酸和0.1 mol·L-1 NaOH溶液;
②取一片此胃药片(药片质量均相等,每片为0.2g),磨碎后转移至锥形瓶中;
③以酚酞为指示剂,用0.1 mol·L-1 NaOH溶液滴定,用去Vx mL NaOH溶液时达到滴定终点;
④加入25 mL 0.1 mol·L-l盐酸。
(1)为使测定结果准确,至少需要滴定两次,得到的Vx值分别为Vl和V2。写出全部实验过程中,各步操作的正确顺序(填编号):_________。
(2)图中所示仪器中,配制0.1 mol·L-1盐酸和0.1 mol·L-1 NaOH溶液肯定不需要的仪器是是________(填序号);配制上述溶液还需要用到的玻璃仪器是________(量取液体的仪器除外)________________(填仪器名称)。
(3)写出相关化学方程式:_________________________________________________________
____________________________________________________________________。
(4)每片胃药中含CaCO3的质量为________________g。
查看习题详情和答案>>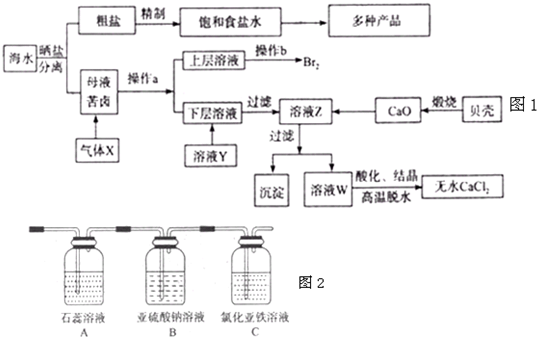
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,梢制时所用的试剂为:A.盐酸B.氯化钡溶 液C.氢氧化钠溶液D.碳酸钠溶液,则加入试剂的顺序是(填编号)
(2)气体X的化学式为
(3)加入溶液Y的目的是
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
①通入气体X后,A中出现的现象是
②C装置中发生反应的离子方程式为
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤)

①配制浓度均为1 mol·L-1的盐酸和醋酸溶液;
②在广口瓶乙中装水,按图示连接好装置,检查装置的气密性;
③量取10.00 mL 1 mol·L-1的盐酸和醋酸溶液分别加入两套装置的锥形瓶中;
④称取两份质量均为a g的镁条(除去表面氧化膜、表面积相同),并固定于塑料杆末端;
⑤同时将塑料杆向下移动,使镁条浸入酸中至反应完全;
⑥反应结束后待温度恢复到室温,读出量筒中水的体积为V mL。
请根据上述步骤回答下列问题:
(1)用文字表述步骤②中检查该装置气密性的方法:_____________________。
(2)量取10.00 mL1mol·L-1盐酸和醋酸溶液分别注入锥形瓶中时,所用的仪器是_________(填下列各项序号字母)。
A.50 mL量筒 B.10 mL量筒
C.25 mL酸式滴定管 D.25 mL碱式滴定管
(3)步骤④中,理论上称取的镁条质量不能少于_________ g。
(4)步骤⑤中需记录的数据是_______;实验过程中观察到的主要现象是______________。
(5)步骤⑥中,读取量筒中水的体积时若俯视读数,对计算该条件下的气体摩尔体积影响为_________(填“偏大”“偏小”或“无法确定”)。
(6)为保证实验顺利进行,仪器丙应选用的规格是_________(填序号字母)。
A.100 mL B.200 mL C.500 mL
(7)若水蒸气的挥发影响忽略不计,在该温度和压强下,气体摩尔体积为______ L·mol-1。
查看习题详情和答案>>(12分)化合物A结构简式为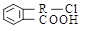 (其中R为饱和烃基),在一定条件下发生如图所示转化关系:
(其中R为饱和烃基),在一定条件下发生如图所示转化关系: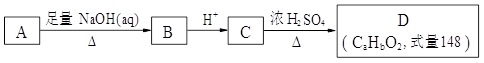
完成下列填空:
(1)关于上述各步转化,下列说法正确的是 ______(选填序号)。
a. 以上转化未涉及加成反应
b. D比C的相对分子质量小18
c. A、B、C、D中都含有—COOH
d. A跟C发生酯化反应,产物分子式为C18H18O4Cl
(2)A可能的结构简式有:_____________________________________________________。
(3)D的分子式为_________________,可能的结构有___________种。
(4)若D中除苯环外,还有一个六元环,写出A→B的化学方程式:
______________________________________________________________。
(12分)化合物A结构简式为 (其中R为饱和烃基),在一定条件下发生如图所示转化关系:
(其中R为饱和烃基),在一定条件下发生如图所示转化关系:
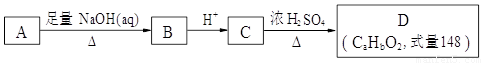
完成下列填空:
(1)关于上述各步转化,下列说法正确的是 ______(选填序号)。
a. 以上转化未涉及加成反应
b. D比C的相对分子质量小18
c. A、B、C、D中都含有—COOH
d. A跟C发生酯化反应,产物分子式为C18H18O4Cl
(2)A可能的结构简式有:_____________________________________________________。
(3)D的分子式为_________________,可能的结构有___________种。
(4)若D中除苯环外,还有一个六元环,写出A→B的化学方程式:
______________________________________________________________。
查看习题详情和答案>>