摘要:12. (1)镁.铝.氯.碳, (2) ., (3)Al3++3OH-===Al(OH)3↓,Al(OH)3+OH-==AlO2-+2H2O.
网址:http://m.1010jiajiao.com/timu3_id_365936[举报]
实验室通过简单的“试管实验”,即可探究元素金属性、非金属性的强弱,请你选用下列试剂,根据实验要求完成下表.
试剂:①镁条 ②铝条 ③AlCl3溶液 ④MgCl2溶液
⑤NaOH溶液 ⑥氯水 ⑦溴水 ⑧NaBr溶液
写出实验(2)中所发生的离子反应方程式
查看习题详情和答案>>
试剂:①镁条 ②铝条 ③AlCl3溶液 ④MgCl2溶液
⑤NaOH溶液 ⑥氯水 ⑦溴水 ⑧NaBr溶液
| 实验方案 (只填写选用试剂序号) |
实验现象 | 结论 | |
| (1) | ③④⑤ ③④⑤ |
一支试管中有白色沉淀生成,另一支试管中先生成白色沉淀,后白色沉淀消失 | 金属性: Mg>Al Mg>Al |
| (2) | ⑥⑧ ⑥⑧ |
溶液由无色变为黄色(或橙黄) 溶液由无色变为黄色(或橙黄) |
非金属性:Cl>Br |
Cl2+2Br-=2Cl-+Br2
Cl2+2Br-=2Cl-+Br2
.某化学兴趣小组的同学学习了同周期元素性质递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象如下表.
请你帮助该同学整理并完成实验报告
(1)实验目的:
(2)实验用品:仪器:①
药品:钠、镁带、铝条、2mol.L-1的盐酸、新制的氯水、饱和H2S溶液、AlCl3溶液、NaOH溶液等.
(3)请你写出上述的实验操作与对应的现象
1
(4)实验结论:
(5)设计一个不同于本题给予的实验方案,证明金属性镁比铝强(试剂任选,简述实验原理):
查看习题详情和答案>>
| 实验操作 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,在水面上无定向移 动,随之消失,溶液变红色 (B)产生气体,可在空气中燃烧,溶液变成浅红色 (C)反应不十分强烈,产生的气体可以在空气中燃 烧 (D)剧烈反应,产生可燃性气体 (E)溶液的碱性逐渐减弱 (F)生成淡黄色沉淀 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 | |
| 3.钠与滴有酚酞试液的冷水反应 | |
| 4.镁带与2mol.L-1的盐酸反应 | |
| 5.铝条与2mol.L-1的盐酸反应 | |
| 6.测定 0.1mol/L的Na2SiO3、Na3PO4、Na2SO4溶液的pH |
(1)实验目的:
探究同周期元素性质的递变规律
探究同周期元素性质的递变规律
.(2)实验用品:仪器:①
试管
试管
②烧杯
烧杯
③酒精灯
酒精灯
④试管夹 ⑤镊子 ⑥小刀 ⑦玻璃片⑧砂纸 ⑨胶头滴管等药品:钠、镁带、铝条、2mol.L-1的盐酸、新制的氯水、饱和H2S溶液、AlCl3溶液、NaOH溶液等.
(3)请你写出上述的实验操作与对应的现象
1
B
B
,2F
F
,3A
A
,4D
D
,5C
C
,6E
E
(用A-F表示)(4)实验结论:
金属性:Na>Mg>Al非金属性:Cl>S(或同周期元素,随原子序数的递增,元素的金属性减弱,非金属性增强)
金属性:Na>Mg>Al非金属性:Cl>S(或同周期元素,随原子序数的递增,元素的金属性减弱,非金属性增强)
.(5)设计一个不同于本题给予的实验方案,证明金属性镁比铝强(试剂任选,简述实验原理):
镁铝导线相连,平行插入硫酸溶液,现象:镁逐渐溶解,铝片表面产生气泡.
镁铝导线相连,平行插入硫酸溶液,现象:镁逐渐溶解,铝片表面产生气泡.
.元素周期律是学习和研究化学的重要工具.下表是元素周期表的部分信息:
认真分析信息,回答:
(1)地壳中含量最多的元素的原子序数是
(2)分析上表规律,可推知,表中X=
(3)Ca失去最外层电子后的微粒表示的是(写粒子符号)
(4)写出一个由1、8号两种元素组成的化合物的化学式
查看习题详情和答案>>
认真分析信息,回答:
| 1H 氢 |
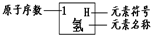 |
2He 氦 | ||||||
| 3Li 锂 |
4Be 铍 |
5B 硼 |
6C 碳 |
7N 氮 |
8O 氧 |
9F 氟 |
10Ne 氖 | |
| llNa 钠 |
12Mg 镁 |
13A1 铝 |
14Si 硅 |
15P 磷 |
16S 硫 |
XC1 氯 |
18Ar 氩 | |
| 19K 钾 |
20Ca 钙 |
… | ||||||
8
8
;(2)分析上表规律,可推知,表中X=
17
17
;(3)Ca失去最外层电子后的微粒表示的是(写粒子符号)
Ca2+
Ca2+
;(4)写出一个由1、8号两种元素组成的化合物的化学式
H2O或H2O2
H2O或H2O2
.从海水中可以获得淡水、食盐并可提取镁和溴等物质.
(1)贝壳的主要成分是
(2)经过化学变化才能从海水中获得的物质是
A.氯、溴、碘 B.钠、镁、铝 C.烧碱、氢气 D.食盐、淡水
(3)从海水中提取镁的流程如图所示:
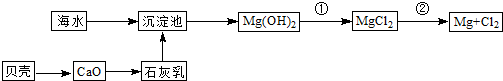
反应①的离子方程式为
反应②的化学方程式为
(4)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为
查看习题详情和答案>>
(1)贝壳的主要成分是
CaCO3
CaCO3
(填化学式);海水淡化的方法主要有海水冻结法、电渗析法、蒸馏法、离子交换法(选填其中一个)
海水冻结法、电渗析法、蒸馏法、离子交换法(选填其中一个)
(填一种).(2)经过化学变化才能从海水中获得的物质是
D
D
(填序号)A.氯、溴、碘 B.钠、镁、铝 C.烧碱、氢气 D.食盐、淡水
(3)从海水中提取镁的流程如图所示:

反应①的离子方程式为
Mg(OH)2+2H+═Mg2++2H2O
Mg(OH)2+2H+═Mg2++2H2O
.反应②的化学方程式为
MgCl2(熔融)
Mg+Cl2↑
| ||
MgCl2(熔融)
Mg+Cl2↑
.
| ||
(4)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为
2Br-+Cl2═Br2+2Cl-
2Br-+Cl2═Br2+2Cl-
.实验室有下列用品:
仪器:试管、胶头滴管、酒精灯、试管夹、镊子、小刀、玻璃片、砂纸等.
药品:金属钠、镁条、铝条、蒸馏水、稀盐酸、新制硫化钠溶液、酚酞溶液、新制氯水等.
(1)某同学设计如下实验,请写下表中的空白处.
(2)写出该实验的实验目的:
(3)若利用上述用品,验证S、Cl两元素得电子能力的相对强弱,试用离子方程式表示:
(4)由上述(1)(2)(3)得出的实验结论:
(5)请用原子结构的简单知识解释上述结论:
查看习题详情和答案>>
仪器:试管、胶头滴管、酒精灯、试管夹、镊子、小刀、玻璃片、砂纸等.
药品:金属钠、镁条、铝条、蒸馏水、稀盐酸、新制硫化钠溶液、酚酞溶液、新制氯水等.
(1)某同学设计如下实验,请写下表中的空白处.
| 编号 | 实验步骤 | 实验现象 | 化学方程式 | ||||||||
| ① | 将一小块钠放入滴有 酚酞溶液的冷水中 |
钠浮在水面上,熔成闪亮 的小球,四处游动,发出 嘶嘶的声音,最后消失, 溶液变为红色 |
2Na+2H2O=2NaOH+H2↑ | ||||||||
| ② | 将镁条用砂纸打磨 后,放入冷水中,滴 入几滴酚酞试液,然 后加热至沸腾; |
与冷水反应缓慢;加热煮沸有气体产生,溶液变为浅红色 | Mg+2H2O
Mg+2H2O
| ||||||||
| ③ | 将镁条投入稀盐酸中 | 强烈反应,迅速产生大量无色气体 | Mg+2HCl=MgCl2+H2↑ | ||||||||
| ④ | 将铝条投入稀盐酸中 | 比镁反应的速率慢一些,产生气体 | 2Al+6HCl=2AlCl3+3H2↑ 2Al+6HCl=2AlCl3+3H2↑ |
探究钠、镁、铝失电子能力的相对强弱
探究钠、镁、铝失电子能力的相对强弱
.(3)若利用上述用品,验证S、Cl两元素得电子能力的相对强弱,试用离子方程式表示:
Cl2+S2-=2Cl-+S↓
Cl2+S2-=2Cl-+S↓
(4)由上述(1)(2)(3)得出的实验结论:
失电子能力Na>Mg>Al,得电子能力Cl>S,即同一周期,从左往右,失电子能力逐渐减弱、得电子能力逐渐增强
失电子能力Na>Mg>Al,得电子能力Cl>S,即同一周期,从左往右,失电子能力逐渐减弱、得电子能力逐渐增强
.(5)请用原子结构的简单知识解释上述结论:
同一周期,各元素原子的核外电子层数相同,从左往右,核电荷数依次增多,原子半径逐渐减小(稀有气体除外),原子核对核外电子的吸引力逐渐增强,表现在性质上,失电子能力逐渐减弱、得电子能力逐渐增强.
同一周期,各元素原子的核外电子层数相同,从左往右,核电荷数依次增多,原子半径逐渐减小(稀有气体除外),原子核对核外电子的吸引力逐渐增强,表现在性质上,失电子能力逐渐减弱、得电子能力逐渐增强.
.