摘要:A 8.D 9.C 10.B 11.A 12.B
网址:http://m.1010jiajiao.com/timu3_id_3656[举报]
镁、氧化镁、氢氧化镁、碳酸镁的固体混合物20.6g,恰好能和200g质量分数为9.8%的稀硫酸完全反应,反应后溶液重216g,则所得溶液中溶质的质量分数为
- A.10.9%
- B.13.2%
- C.11.1%
- D.12.9%
镁、氧化镁、氢氧化镁、碳酸镁的固体混合物20.6g,恰好能和200g质量分数为9.8%的稀硫酸完全反应,反应后溶液重216g,则所得溶液中溶质的质量分数为
[ ]
A.10.9%
B.13.2%
C.11.1%
D.12.9%
镁、氧化镁、氢氧化镁、碳酸镁的固体混合物20.6g,恰好能和200g质量分数为9.8%的稀硫酸完全反应,反应后溶液重216g,则所得溶液中溶质的质量分数为
[ ]
A.10.9%
B.13.2%
C.11.1%
D.12.9%
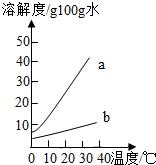
以下是Na2CO3、NaHCO3的溶解度表及溶解度曲线.
要除去NaHCO3固体中的少量Na2CO3,应采用的物理方法是( )
查看习题详情和答案>>
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | |
| Na2CO3的溶解度(g/100g水) | 7.1 | 12.5 | 21.5 | 39.7 | 49.0 |
| NaHCO3的溶解度(g/100g水) | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 |
| A.冷却结晶 | B.蒸发结晶 | C.溶解过滤 | D.加适量盐酸 |

过碳酸钠广泛用于洗涤、纺织、医疗、造纸等.某兴趣小组展开了深入的学习:
[资料卡片]:
Ⅰ、制备研究:如图1是制备过碳酸钠的工艺流程.

请回答问题:
(1)反应器中发生反应的化学方程式为______;
(2)生产中,反应及干燥均需在较低温度下进行,原因是______;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为______.
(4)操作A的名称是______,若在实验室完成此操作,需要的玻璃仪器是烧杯、______和______;
(5)洗涤过碳酸钠晶体最好选用______.
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是______和______;
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数.
小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验.
[实验步骤]:①______;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中______时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算.
[实验分析及数据处理]:
(7)完善实验步骤的相关内容:①______、④______;
(8)实验中,水的作用是______;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是______(填化学式);
(9)实验中,______,则开始收集气体;
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL,计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数[Mr=314、Mr(O2)=32]______;
[实验反思]:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是______;
(12)量筒中长导管的作用是______;
(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由.______;
(14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3?3H2O2的质量分数为______.
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3?3H2O2的质量分数?______.(只需给出简要的方案)
查看习题详情和答案>>
[资料卡片]:
| 1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解; 2、过碳酸钠分解的化学方程式为2=4 Na2CO3+6 H2O+3O2↑ 3、H2O2分解放出热量,Na2CO3受热不分解; |

请回答问题:
(1)反应器中发生反应的化学方程式为______;
(2)生产中,反应及干燥均需在较低温度下进行,原因是______;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为______.
(4)操作A的名称是______,若在实验室完成此操作,需要的玻璃仪器是烧杯、______和______;
(5)洗涤过碳酸钠晶体最好选用______.
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是______和______;
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数.
小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验.
[实验步骤]:①______;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中______时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算.
[实验分析及数据处理]:
(7)完善实验步骤的相关内容:①______、④______;
(8)实验中,水的作用是______;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是______(填化学式);
(9)实验中,______,则开始收集气体;
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL,计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数[Mr=314、Mr(O2)=32]______;
[实验反思]:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是______;
(12)量筒中长导管的作用是______;
(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由.______;
(14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3?3H2O2的质量分数为______.
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3?3H2O2的质量分数?______.(只需给出简要的方案)
查看习题详情和答案>>