摘要:恒温恒压下.在容积可变的器血中.反应2NO2(气) N2O4(气)达到平衡后.再向容器内通入一定量NO2.又达到平衡时.N2O4的体积分数 A.不变 B.增大 C.减小 D.无法判断
网址:http://m.1010jiajiao.com/timu3_id_365586[举报]
恒温恒压下,在容积可变的器血中,反应2NO2(气)![]() N2O4(气)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4(气)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
(1)CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:CO+Hb?O2 O2+Hb?CO
O2+Hb?CO
实验表明,c即使只有c的 1/50,也可造成人的智力损伤.
已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol?L-1,若使c小于c的 1/50,则吸入肺部CO的浓度不能超过______mol?L-1.
(2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.
已知反应2NO(g)+2CO(g) N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1
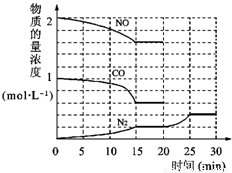
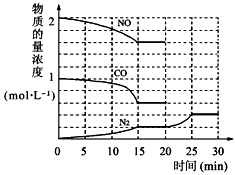
①为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入lL反应容器中,反应过程中NO(g)、CO(g)、N2(g)物质的量浓度变化如右下图所示.反应进行到15min时,NO的平均反应速率为______,
②观察在20min~30min内N2(g)发生变化的曲线图,判断引起该变化的条件可能是______;
a.加入催化剂
b.降低体系温度
c.缩小容器体积为0.5L
d.增加CO2的物质的量
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
试回答下列问题
①上述正向反应是:______反应(填“放热”、“吸热”).
②某温度下上述反应平衡时,恒容、升高温度,正反应速率______(填“增大”、“减小”或“不变”),容器内混合气体的压强______(填“增大”、“减小”或“不变”).
③在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有______(选填A、B、C、D).
 查看习题详情和答案>>
查看习题详情和答案>>
(1)CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:CO+Hb?O2
 O2+Hb?CO
O2+Hb?CO实验表明,c即使只有c的 1/50,也可造成人的智力损伤.
已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol?L-1,若使c小于c的 1/50,则吸入肺部CO的浓度不能超过______mol?L-1.
(2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.
已知反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1①为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入lL反应容器中,反应过程中NO(g)、CO(g)、N2(g)物质的量浓度变化如右下图所示.反应进行到15min时,NO的平均反应速率为______,
②观察在20min~30min内N2(g)发生变化的曲线图,判断引起该变化的条件可能是______;
a.加入催化剂
b.降低体系温度
c.缩小容器体积为0.5L
d.增加CO2的物质的量
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H2O(g)
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
①上述正向反应是:______反应(填“放热”、“吸热”).
②某温度下上述反应平衡时,恒容、升高温度,正反应速率______(填“增大”、“减小”或“不变”),容器内混合气体的压强______(填“增大”、“减小”或“不变”).
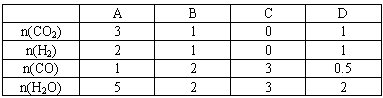
③在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有______(选填A、B、C、D).
| A | B | C | D | |
| n(CO2) | 3 | 1 | 1 | |
| n(H2) | 2 | 1 | 1 | |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
 查看习题详情和答案>>
查看习题详情和答案>>
 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.(1)CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:CO+Hb?O2
 O2+Hb?CO
O2+Hb?CO实验表明,c(Hb?CO)即使只有c(Hb?O2)的 1/50,也可造成人的智力损伤.
已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol?L-1,若使c(Hb?CO)小于c(Hb?O2)的 1/50,则吸入肺部CO的浓度不能超过
1.0×10-6
1.0×10-6
mol?L-1.(2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.
已知反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)△H=-113kJ?mol-1
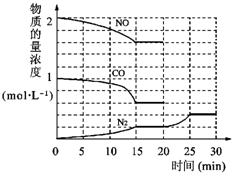
N2(g)+2CO2(g)△H=-113kJ?mol-1①为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入lL反应容器中,反应过程中NO(g)、CO(g)、N2(g)物质的量浓度变化如右下图所示.反应进行到15min时,NO的平均反应速率为
| 0.4 |
| 15 |
| 0.4 |
| 15 |
②观察在20min~30min内N2(g)发生变化的曲线图,判断引起该变化的条件可能是
b
b
;a.加入催化剂
b.降低体系温度
c.缩小容器体积为0.5L
d.增加CO2的物质的量
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H2O(g)
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
①上述正向反应是:
放热
放热
反应(填“放热”、“吸热”).②某温度下上述反应平衡时,恒容、升高温度,正反应速率
增大
增大
(填“增大”、“减小”或“不变”),容器内混合气体的压强增大
增大
(填“增大”、“减小”或“不变”).③在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有
B、C
B、C
(选填A、B、C、D).| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
环境问题备受世界关注。化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素。
(1)CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:CO+Hb·O2 O2+Hb·CO 实验表明,c(Hb·CO)即使只有c(Hb·O2)的1/50,也可造成人的智力损伤。已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol·L-1,若使c(Hb·CO)小于c(Hb·O2)的1/50,则吸入肺部CO的浓度不能超过_________mol·L-1。
O2+Hb·CO 实验表明,c(Hb·CO)即使只有c(Hb·O2)的1/50,也可造成人的智力损伤。已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol·L-1,若使c(Hb·CO)小于c(Hb·O2)的1/50,则吸入肺部CO的浓度不能超过_________mol·L-1。
(2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”。已知反应2NO(g) + 2CO(g) N2(g) + 2CO2(g) △H=-113kJ·mol-1
N2(g) + 2CO2(g) △H=-113kJ·mol-1
①为了模拟催化转化器的工作原理,在t℃时,将2 molNO与1 mol CO充入1L反应容器中,反应过程中NO(g)、CO(g)、N2(g)物质的量浓度变化如下图所示。反应进行到15min时,NO的平均反应速率为_____________,
②观察在20 min~30 min内N2(g)发生变化的曲线图,判断引起该变化的条件可能是_______________;
a.加入催化剂 b.降低体系温度 c.缩小容器体积为0.5L d.增加CO2的物质的量
(1)CO的中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应方程式可表示为:CO+Hb·O2
 O2+Hb·CO 实验表明,c(Hb·CO)即使只有c(Hb·O2)的1/50,也可造成人的智力损伤。已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol·L-1,若使c(Hb·CO)小于c(Hb·O2)的1/50,则吸入肺部CO的浓度不能超过_________mol·L-1。
O2+Hb·CO 实验表明,c(Hb·CO)即使只有c(Hb·O2)的1/50,也可造成人的智力损伤。已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol·L-1,若使c(Hb·CO)小于c(Hb·O2)的1/50,则吸入肺部CO的浓度不能超过_________mol·L-1。(2)汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”。已知反应2NO(g) + 2CO(g)
 N2(g) + 2CO2(g) △H=-113kJ·mol-1
N2(g) + 2CO2(g) △H=-113kJ·mol-1①为了模拟催化转化器的工作原理,在t℃时,将2 molNO与1 mol CO充入1L反应容器中,反应过程中NO(g)、CO(g)、N2(g)物质的量浓度变化如下图所示。反应进行到15min时,NO的平均反应速率为_____________,
②观察在20 min~30 min内N2(g)发生变化的曲线图,判断引起该变化的条件可能是_______________;
a.加入催化剂 b.降低体系温度 c.缩小容器体积为0.5L d.增加CO2的物质的量
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表: 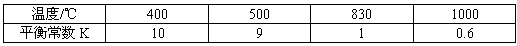
试回答下列问题①上述正向反应是:____________反应(填“放热”、“吸热”)。②某温度下上述反应平衡时,恒容、升高温度,正反应速率____________(填“增大”、“减小”或“不变”),容器内混合气体的压强__________________(填“增大”、“减小”或“不变”)。③在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有______________(选填A、B、C、D)。
(10分)研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义。某学习小组查阅资料并进行相关探究,请帮忙完成以下探究。
(1)pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图。请回答下列问题:(若离子浓度小于10-5mol/L,可认为该离子不存在)
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②H2CO3一级电离平衡常数的数值Ka1 。
。
③人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)可以抵消少量酸或碱,维持pH 7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
| A.变大 | B.变小 | C.基本不变 | D.无法判断 |

该电池反应的离子方程式为 。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为: CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) △H ;
CH3OH(g) +H2O(g) △H ;①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图
所示,则上述CO2转化为甲醇反应热ΔH 0(填“>” “<”或“=”)。

②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物 投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |