��Ŀ����
��10�֣��о�̼���仯��������öԴٽ���̼���Ĺ���������Ҫ�����塣ijѧϰС��������ϲ��������̽�������æ�������̽����
��1��pC������pH����ָ��ϡ��Һ�е�����Ũ�ȵij��ö����ĸ�ֵ����ij��Һ��ij���ʵ�Ũ��Ϊ1��10��3 mol/L�������Һ�и����ʵ�pC����lg(1��10��3)��3����ͼΪ25��ʱH2CO3��Һ��pC��pHͼ����ش��������⣺��������Ũ��С��10-5mol/L������Ϊ�����Ӳ����ڣ�
����ͬһ��Һ�У�H2CO3��HCO3����CO32��________(��ܡ����ܡ�)�������档
��H2CO3һ������ƽ�ⳣ������ֵKa1 ��
��
������ѪҺ����Ҫͨ��̼�����λ�����ϵ(H2CO3/HCO3��)���Ե����������ά��pH 7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е�c(H+)/c(H2CO3)���ս� ��
7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е�c(H+)/c(H2CO3)���ս� ��
| A����� | B����С | C���������� | D�����ж� |

�õ�ط�Ӧ�����ӷ���ʽΪ ��
��3��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ�� CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) ��H ��
CH3OH(g) +H2O(g) ��H ����ȡ��ݵ����CO2��H2�Ļ������(���ʵ���֮�Ⱦ�Ϊ1��3)���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ������ͼ
��ʾ��������CO2ת��Ϊ�״���Ӧ�Ȧ�H 0(�>�� ��<������)��

��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽͶ�뷴Ӧ�һ��ʱ���ﵽƽ�⡣
| �� �� | �� | �� |
| ��Ӧ�� Ͷ���� | 1molCO2 3molH2 | a molCO2��b molH2�� c molCH3OH(g)��c molH2O(g) |
����10�֣�
��1���ٲ��� (1��) ��10-6�� (2��) ��A��(1��)
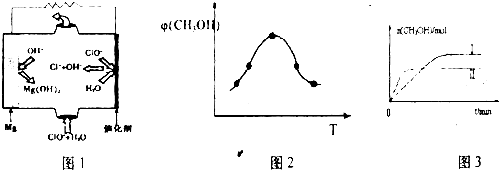
��2��Mg + ClO- + H2O = Cl- + Mg(OH)2��2�֣���
��3���٣� (2��) �� 0.4��c��1 ��2�֣���
���������������1���٣�H2CO3�ᷢ�������H+�� HCO3���ᷢ�������H+�ͷ���ˮ����H+�� CO32���ᷢ��ˮ����H+��ϣ���H2CO3��HCO3����CO32�����ܴ������档�ڷ���ͼ�п��Կ�����PH=6ʱH2CO3����һ�����룬���Ka1 10-6���۹������Ậ�д�����H+�����c(H+)/c(H2CO3)���ս����
10-6���۹������Ậ�д�����H+�����c(H+)/c(H2CO3)���ս����
��2����ͼ�з����ó���Mg�Ǹ�����ʧȥ���ӣ�����Mg(OH)2��ClO-��õ���������Cl-����˵�ط�Ӧ�����ӷ���ʽΪ��Mg + ClO- + H2O = Cl- + Mg(OH)2��
��3������ͼ��֪��ߵ㷴Ӧ����ƽ�⣬��ƽ����¶�Խ�ߣ��գ�CH3OH��ԽС��ƽ�����淴Ӧ���У������¶�ƽ�����ȷ�����У��淴ӦΪ���ȷ�Ӧ��������ӦΪ���ȷ�Ӧ������H3��0��
�ʴ�Ϊ������
�ڸ��ݷ�����ѧ����ʽ����Ӧǰ��Ļ�ѧ�����ʵ���֮����2:1������Ϊ����ƽ��������ѹǿΪ��ʼʱ��0.8�������c����С��Ϊ0.8/[��1mol+3mol��/2]=0.4mol,���ֵΪ1mol����c��ȡֵ��ΧΪ��0.4��c��1��
���㣺"����"�����뻷������ �Ȼ�ѧ����ʽ ԭ��غ͵��صĹ���ԭ�� ��ѧƽ���Ӱ������ ��ѧƽ��ļ��� ���������ˮ��Һ�еĵ���ƽ�� ���ܵ���ʵ��ܽ�ƽ�⼰����ת���ı��� �����ʱ�Ķ����жϼ��й�ph�ļ���
��������1�����⿼�����������ˮ��Һ�еĵ��뼰ͼ��ѧ������ȷ������ͼ���������ǽ����Ĺؼ�����ע������ϰ���е���Ϣ������ѶȲ���2������Ӷ���ǶȶԻ�ʯȼ�Ͻ�����ȫ��Ŀ��飬�Ѷ��еȣ�������ѧ�����������������������

�о�̼���仯��������ʶԴٽ���̼���Ĺ���������Ҫ���塣
(1)����ͬ����CO(g)��H2O(g)�ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У����з�Ӧ
CO(g)��H2O(g)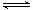 CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
|
ʵ���� |
�¶ȡ� |
��ʼ��/mol |
ƽ����/mol |
�ﵽƽ������ʱ��/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
��ʵ��1����CO2��ʾ�ķ�Ӧ����Ϊ_____________(����2λС��)��
�ڸ÷�ӦΪ___________(����ȡ����ȡ�)��Ӧ��
��ʵ��2��ƽ�ⳣ��Ϊ___________________________��
(2)��֪�ڳ��³�ѹ�£�
2CH3OH(l)+3O2(g)��2CO2(g)+4H2O(l) ��H����1451.6kJ/mol
2CO(g)+O2(g)��2CO2(g) ��H����566.0kJ/mol
д���״�����ȫȼ������CO��Һ̬ˮ���Ȼ�ѧ����ʽ_______________________________��
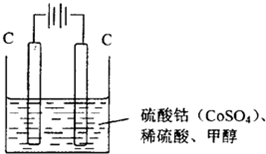
(3)�״���ˮ�ʻ����һ������Ⱦ����һ�ֵ绯ѧ��������������Ⱦ��ʵ��������ͼװ��ģ��ù��̣���ԭ���ǣ�ͨ���Co2+��������Co3+��Ȼ����Co3+���������Ѽ״�������CO2����ȥ(Co3+�Ļ�ԭ������CO2+)��
��д�������缫��Ӧʽ_______________________________________________________________ ��
��д����ȥ�״������ӷ���ʽ__________________________________________________________��
��10�֣��о�̼���仯��������öԴٽ���̼���Ĺ���������Ҫ�����塣ijѧϰС��������ϲ��������̽�������æ�������̽����
��1��pC������pH����ָ��ϡ��Һ�е�����Ũ�ȵij��ö����ĸ�ֵ����ij��Һ��ij���ʵ�Ũ��Ϊ1��10��3 mol/L�������Һ�и����ʵ�pC����lg(1��10��3)��3����ͼΪ25��ʱH2CO3��Һ��pC��pHͼ����ش��������⣺��������Ũ��С��10-5mol/L������Ϊ�����Ӳ����ڣ�

����ͬһ��Һ�У�H2CO3��HCO3����CO32��________(��ܡ����ܡ�)�������档
��H2CO3һ������ƽ�ⳣ������ֵKa1 ��
��
������ѪҺ����Ҫͨ��̼�����λ�����ϵ(H2CO3/HCO3��)���Ե����������ά��pH 7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е�c(H+)/c(H2CO3)���ս� ��
7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е�c(H+)/c(H2CO3)���ս� ��
A����� B����С C���������� D�����ж�
��2������ʱ����CO��ԭMgSO4���Ʊ��ߴ�MgO����MgO���Ƴɡ�þ���������Ρ�ȼ�ϵ�أ���װ��ʾ��ͼ��ͼ��

�õ�ط�Ӧ�����ӷ���ʽΪ ��
��3��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ�� CO2(g) +3H2(g)  CH3OH(g) +H2O(g) ��H
��
CH3OH(g) +H2O(g) ��H
��
��ȡ��ݵ����CO2��H2�Ļ������(���ʵ���֮�Ⱦ�Ϊ1��3)���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ������ͼ
��ʾ��������CO2ת��Ϊ�״���Ӧ�Ȧ�H 0(�>�� ��<������)��

��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽͶ�뷴Ӧ�һ��ʱ���ﵽƽ�⡣
|
�� �� |
�� |
�� |
|
��Ӧ�� Ͷ���� |
1molCO2 3molH2 |
a molCO2��b molH2�� c molCH3OH(g)��c molH2O(g) |
������ƽ��������ѹǿΪ��ʼʱ��0.8����Ҫʹƽ���������и�����Ũ����ͬ������ʼʱά�ַ�Ӧ������У���c��ȡֵ��ΧΪ ��
 ��2013?̩��һģ���о�̼���仯��������ʶԴٽ���̼���Ĺ���������Ҫ���壮
��2013?̩��һģ���о�̼���仯��������ʶԴٽ���̼���Ĺ���������Ҫ���壮