摘要:在一定容积的密闭容器中.进行如下化学反应:CO + H2O(g) CO 2+ H2.其化学平衡常数K与温度T的关系如下表: T(℃) 700 800 830 1000 1200 K 0.6 0.9 1.0 1.7 2.6 回答下列问题: (1)该反应的逆反应为 热反应. (2)判断该反应到达平衡的依据是 A.容器内压强不变 B.混合气体中c(CO)不变 C.v 正(H2)= v逆(H2O) D.c(CO)== c(CO2) E.K值不变 F.c(CO)/ c(H2O)不变 (3)在一体积为10 L的容器中.通入一定量的CO和H2O.在T1℃时发生反应. ①CO和H2O的浓度变化如下图所示.则在0~ 4 min时正反应的平均反应速率为 v(CO)= . ②此反应的温度 830℃. ③图中6min~7min之间浓度发生变化的原因可 能是: . A.只充入水蒸气 B.只降低温度 C.只使用催化剂 D.只充入惰性气体 E.增大压强 F.只充入CO2 (4)830℃时.起始浓度c(CO)= a mol/L. c(H2O)= b mol/L.平衡时c(H2)= c mol/L. 则: ①a.b.c 之间的关系是 .② 当a= b时.a = c
网址:http://m.1010jiajiao.com/timu3_id_365268[举报]
在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
请回答下列问题:
(1)该反应的化学平衡常数表达式K=
.
(2)该反应为
(3)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01mol/L,
c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率
(4)830℃,在1L的固定容器的密闭容器中放入2molCO2和1molH2,平衡后CO2的转化率为
,H2的转化率为
.
查看习题详情和答案>>
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K=
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
(2)该反应为
吸热
吸热
反应.(填“吸热”或“放热”)(3)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01mol/L,
c(H2O)=0.03mol/L,c(CO2)=0.01mol/L,c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率
小
小
(填“大““小“或“不能确定“)(4)830℃,在1L的固定容器的密闭容器中放入2molCO2和1molH2,平衡后CO2的转化率为
| 1 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为
 ;
;
(2)反应是
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)?c(CH2)=c(CO)?c(H2O),试判断此时的温度为
查看习题详情和答案>>
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为


(2)反应是
吸热
吸热
反应.(选填“吸热”、放热).(3)能判断该反应是否达到化学平衡状态的依据是
bc
bc
.a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)?c(CH2)=c(CO)?c(H2O),试判断此时的温度为
830
830
℃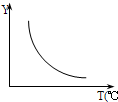 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题:| T℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
>
>
0;若该反应符合如图所示的关系,则在图中,Y轴是指CO2或H2的百分含量等
CO2或H2的百分含量等
. (答出一种即可)(2)能判断该反应达到化学平衡状态的依据是
bc
bc
(多选扣分).a.容器中压强不变 b.混合气体中c(CO)不变
c.v(H2)正=v(H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:0.9?c(CO2)?c(H2)=c(CO)?c(H2O),由此可以判断此时的温度为
800
800
℃.其它条件不变,升高温度,原化学平衡向逆
逆
反应方向移动(填“正”或“逆”),容器内混合气体的平均相对分子质量不变
不变
(填“增大”、“减小”或“不变”).在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应为
(2)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
查看习题详情和答案>>
CO2(g)+H2(g)?CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为
吸热
吸热
反应(选填吸热、放热).(2)能判断该反应是否达到化学平衡状态的依据是
bc
bc
.a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
830
830
℃.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
;
(2)该反应为
(3)某温度下,平衡浓度符合下式:3c(CO2)?c(H2)=5c(CO)?c(H2O),试判断此时的温度为
(4)830℃时,向该容器中加入1L CO2与1L H2,平衡时CO2的体积分数是
查看习题详情和答案>>
CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
(2)该反应为
吸热
吸热
反应(选填吸热、放热);(3)某温度下,平衡浓度符合下式:3c(CO2)?c(H2)=5c(CO)?c(H2O),试判断此时的温度为
700
700
℃;(4)830℃时,向该容器中加入1L CO2与1L H2,平衡时CO2的体积分数是
25%
25%
.